La miel posee varios efectos medicinales y de salud como complemento alimenticio natural. Se ha establecido como un potencial agente antioxidante terapéutico para varias dolencias de la biodiversidad. Los datos informan que exhibe fuertes efectos cicatrizantes, antibacterianos, antiinflamatorios, antifúngicos, antivirales y antidiabéticos. También conserva efectos inmunomoduladores, reguladores estrogénicos, antimutagénicos, anticancerígenos y muchos otros efectos vigorosos. Los datos también muestran que la miel, como terapia convencional, podría ser un nuevo antioxidante para reducir muchas de las enfermedades asociadas directa o indirectamente con el estrés oxidativo. En esta revisión, estos efectos saludables se han revisado a fondo para subrayar el modo de acción de la miel explorando varios mecanismos posibles. La investigación basada en evidencia pretende que la miel actúe a través de una vía moduladora de múltiples vías de señalización y objetivos moleculares. Esta vía contempla varias vías como la inducción de caspasas en la apoptosis; estimulación de TNF- α , IL- 1β , IFN- γ , IFNGR1 y p53; inhibición de la proliferación celular y detención del ciclo celular; inhibición de la oxidación de lipoproteínas, IL-1, IL-10, COX-2 y LOX; y modulación de otros objetivos diversos. La revisión destaca la investigación realizada, así como las oportunidades que se deben investigar. La literatura sugiere que la miel administrada sola o como terapia adyuvante podría ser un potencial agente medicinal antioxidante natural que justifica una mayor investigación experimental y clínica.
Las modalidades actuales de tratamiento que utilizan fármacos quimioterapéuticos disimulan la resistencia a múltiples fármacos y varios otros efectos secundarios [ 1 ]. Esto insta a buscar opciones alternativas. Los productos naturales se consideran un enfoque alternativo práctico para reducir la creciente cantidad de enfermedades y algunos de sus inevitables efectos secundarios [ 2 , 3 ] . Recientemente, la miel como producto natural ha atraído la atención de los investigadores como medicina complementaria y alternativa [ 4–6 ].
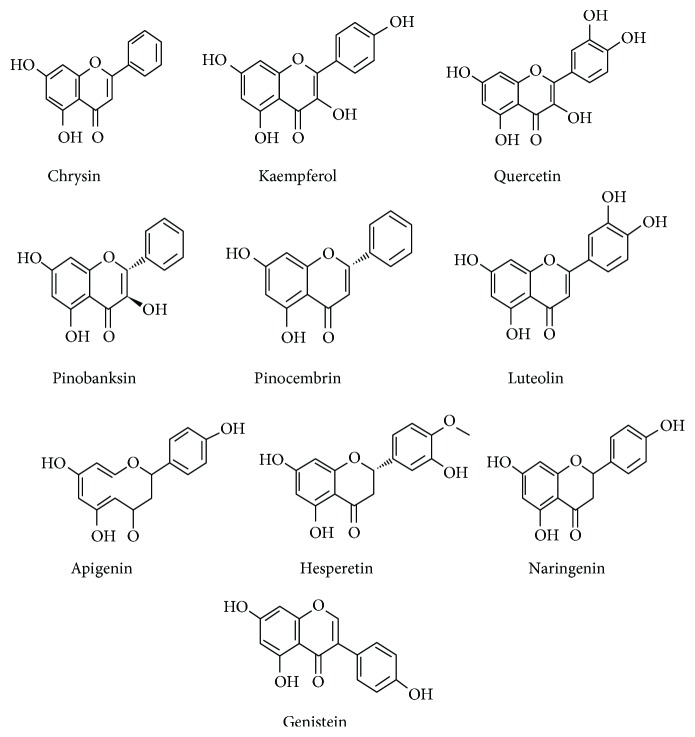
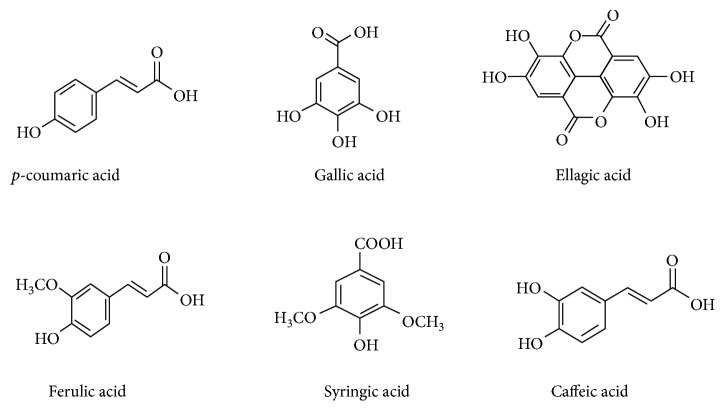
La miel como medicina popular se menciona en los archivos escritos más antiguos [ 7 , 8 ]. La demarcación de sus usos en la medicina profesional actual como una terapia potencial está completamente infrautilizada. Sin embargo, existe una afinidad por parte de algunos investigadores para lanzar una propuesta coherente de que el uso de la miel como un suplemento de producto natural está bien intencionado para la reflexión como terapia o terapia antioxidante adyuvante en la medicina actual [ 9 , 10 ]. La composición de la miel varía de fuente floral a origen. Una composición promedio general de la miel se ha presentado en la Tabla 1. Está compuesta por al menos 181 sustancias y fabrica principalmente fructosa (38%) y glucosa (31%) como azúcares principales. Además de fructosa y glucosa, otros disacáridos identificados incluyen maltosa, sacarosa, maltulosa, turanosa, isomaltosa, laminaribiosa, nigerosa, kojibiosa, gentiobiosa y B-trehalosa. Los trisacáridos incluyen maltotriosa, erlosa, melecitosa, centosa 3-a5, isomaltosilglucosa, l-cestosa, isomaltotriosa, panosa, isopanosa y teanderosa [ 11 ]. También comprende enzimas, aminoácidos, proteínas, flavonoides, ácidos fenólicos y un grupo misceláneo. Hay 26 aminoácidos reportados en la miel; entre ellos, la prolina es el principal contribuyente que constituye el 50-85% de los aminoácidos totales [ 12 ]. El volumen menor de vitaminas incluye riboflavina, niacina, ácido fólico, ácido pantoténico, vitamina B6 y ácido ascórbico. Diferentes oligoelementos cubren calcio, hierro, zinc, potasio, fósforo, magnesio, selenio, cromo y manganeso. Los ácidos orgánicos son otro grupo importante de compuestos en la miel, por ejemplo, ácido acético, butírico, cítrico, succínico, láctico, málico y glucónico y varios otros ácidos aromáticos [ 13 ]. Las diversas enzimas presentes en la miel son la glucosa oxidasa, la sacarosa diastasa, la catalasa y la fosfatasa ácida [ 14 – 16 ]. Algunos de los flavonoides y compuestos fenólicos que se han identificado en la miel incluyen kaempferol, quercetina, crisina, pinobanksina, luteolina, apigenina, pinocembrina, genisteína, hesperetina, ácido p -cumárico, naringenina, ácido gálico, ácido ferúlico, ácido elágico, ácido siríngico, ácido vainílico y ácido cafeico [ 17 , 18 ]. Se ha informado que los flavonoides y los componentes del ácido fenólico son los únicos responsables de los efectos antioxidantes y otros efectos medicinales de la miel [ 6 , 18 – 24 ]. Las estructuras químicas de los principales flavonoides y ácidos fenólicos de la miel se han demostrado en las Figuras 1 y 2 .
Figura 1.
Estructuras químicas de los flavonoides en la miel [ 17 ].
Figura 2.
Estructuras químicas de los ácidos fenólicos en la miel [ 17 ].
La miel se ha estudiado contra varias enfermedades en modelos animales y humanos. La investigación publicada la denota como un nuevo agente antioxidante [ 24 , 25 ]. Exhibe un amplio espectro de propiedades terapéuticas como antiinflamatorias [ 26 ], antibacterianas [ 27 ], antimutagénicas [ 28 ], aceleran la cicatrización de heridas [ 29 ], antidiabéticas [ 30 ], antivirales [ 31 ], antifúngicas [ 32 ] y antitumorales [ 5 , 33 , 34 ]. Podría presentarse como una "vacuna" natural contra el cáncer, ya que reduce la inflamación crónica, mejora la cicatrización de úlceras y heridas crónicas y mejora el estado inmunológico; lo opuesto a estos son factores de riesgo para la formación de cáncer [ 5 ]. Su actividad anticancerígena ha sido probada contra varios tipos de cáncer: mama [ 35 – 39 ], colorrectal [ 40 ], renal [ 41 ], próstata [ 36 ], endometrial [ 36 ], cervical [ 39 ], y oral [ 42 ]. La miel tiene el potencial de reducir los factores de riesgo cardiovascular en individuos normales y sanos [ 43 ]. Provoca una reducción de la presión arterial sistólica y del nivel de triglicéridos y VLDL (lipoproteína de baja densidad) en animales de experimentación [ 44 ]. En un ensayo clínico aleatorizado, se observó una menor incidencia de síntomas respiratorios agudos en individuos que tomaron miel diariamente [ 45 ]. Mejora las hormonas femeninas [ 46 ], aumenta el porcentaje de espermatozoides y la motilidad, y reduce los efectos tóxicos sobre la espermatogénesis y el nivel de testosterona [ 47 , 48 ]. Las mujeres posmenopáusicas que recibieron terapia con miel mostraron una mejora en su memoria inmediata en comparación con la mejora observada en las mujeres que recibieron terapia con estrógeno más progestina [ 49 ].
La comprensión del modo de acción de la miel es un tema de gran importancia y se encuentra en fase de desarrollo. La revisión presenta el papel de la miel en la modulación de diferentes tipos de enfermedades y los posibles mecanismos involucrados. También destaca una sinopsis de los hallazgos a través de los cuales se traza un camino desde diferentes vías de señalización hacia diferentes dianas moleculares. La revisión también muestra las explicaciones racionales de los efectos terapéuticos de la miel y las oportunidades que se deben investigar.
2. Efectos medicinales de la miel y mecanismos de acción
2.1 Efectos antioxidantes de la miel
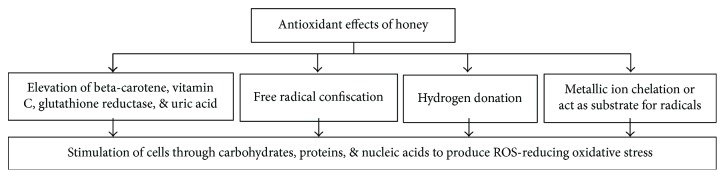
Los antioxidantes son agentes que contrarrestan el deterioro causado por oxidantes como el O2 , OH− , superóxido y/o radicales lipídicos peroxilo. El cáncer, la síntesis de mutágenos, el envejecimiento, la aterosclerosis y muchas enfermedades crónicas y degenerativas persistentes son susceptibles al estrés oxidativo [ 52 ]. Las células exhiben un sistema de defensa contra el daño oxidativo. Este sistema de defensa consiste en radicales libres y otros agentes protectores oxidativos como la catalasa, la superóxido dismutasa, la peroxidasa, el ácido ascórbico, el tocoferol y los polifenoles [ 53 ]. Estos agentes antioxidantes estimulan biomoléculas como carbohidratos, proteínas, lípidos y ácidos nucleicos. Las células se alteran por esta estimulación y, en última instancia, provocan una respuesta antioxidante [ 54 ]. La miel exhibe una fuerte actividad antioxidante [ 6 ]. Esta capacidad antioxidante de la miel contribuye a la prevención de varios trastornos agudos y crónicos como los inflamatorios, alérgicos, trombóticos, diabéticos, cardiovasculares, cáncer y otros. Las propiedades antioxidantes de la miel se pueden medir en forma de actividad antirradical utilizando el ensayo de capacidad de absorción de radicales de oxígeno (ORAC), el ensayo de eliminación de 1,1-difenil-2-picrilhidrazilo (DPPH) y el ensayo de poder antioxidante reductor férrico (FRAP) [ 24 ]. Se ha demostrado que la miel de varios orígenes florales y diferentes países exhibe altas propiedades antioxidantes [ 24 ]. Los ácidos fenólicos y flavonoides son responsables de la actividad antioxidante bien establecida de la miel. Aparte de estos, los azúcares, las proteínas, los aminoácidos, los carotenos, los ácidos orgánicos, los productos de la reacción de Maillard, la producción de especies reactivas de oxígeno (ROS) y otros componentes menores también contribuyen al efecto antioxidante [ 53 , 55 ]. Los investigadores también demostraron que la miel (1,2 g/kg) elevó la cantidad y la actividad de agentes antioxidantes como el betacaroteno, la vitamina C, la glutatión reductasa y el ácido úrico en sujetos humanos sanos [ 56 ]. Se desconoce el mecanismo antioxidante exacto, pero los mecanismos propuestos incluyen secuestro de radicales libres, donación de hidrógeno, quelación de iones metálicos, acción de sustrato de flavonoides para acciones de radicales hidroxilo y superóxido [ 25 , 57 ]. La Figura 3 presenta todos los posibles mecanismos involucrados en los efectos antioxidantes de la miel. El efecto antioxidante de la miel está bien establecido, pero insta a explorar los mecanismos exactos involucrados y la extrapolación a ensayos clínicos.
Figura 3.
Mecanismos de los efectos antioxidantes de la miel.
2.2 Efectos antibacterianos y cicatrizantes de la miel
Diferentes ensayos clínicos y estudios in vitro han reportado propiedades antimicrobianas de amplio espectro de la miel [ 58 ]. Se informó que la miel restringe el crecimiento de cepas patógenas como Streptococcus pyogenes, Streptococcus typhi , Staphylococcus aureus , Streptococcus coagulasa-negativos y E. coli , y especies [ 59 ]. También disminuye el crecimiento de cepas infecciosas como Pseudomonas aeruginosa, Acinetobacter baumannii y Klebsiella pneumonia en heridas por quemaduras de espesor completo en ratas [ 60 ].
El efecto antibacteriano de la miel se atribuye a la presencia de factores antibióticos inertes en ella. Estos factores incluyen su pH ácido, el efecto osmótico de los azúcares y la producción de H 2 O 2 por la peroxidasa. Algunas sustancias no peroxidasas también apoyan la actividad antibacteriana que incluyen flavonoides, ácidos fenólicos y lisozima [ 61 ]. En su mecanismo de acción, un papel importante lo desempeñan la defensina-1 de abeja (péptido antimicrobiano), el metilglioxal (fitoquímico) y la producción de peróxido de hidrógeno por la enzima glucosa oxidasa [ 62 ]. Además, los altos contenidos de azúcar de la miel también pueden ser útiles para eliminar bacterias a través de la ósmosis [ 63 ]. El metilglioxal (MGO) en la miel y su precursor dihidroxiacetona (DHA) han sido reconocidos como inhibidores del crecimiento bacteriano a través de la inhibición de la ureasa. La enzima ureasa facilita que las bacterias se aclimaten y crezcan rápidamente produciendo amoníaco en un entorno ácido [ 64 ]. Un estudio muy reciente revela que la miel combate las infecciones bacterianas mediante dos mecanismos diferentes: inhibición del sistema de detección de quórum (QS) bacteriano para retardar la expresión de los regulones las , MvfR y rhl , así como sus factores de virulencia asociados, y componentes bactericidas que matan activamente las células bacterianas [ 65 ].
Las biopelículas han surgido como un factor clave en la resistencia a los antibióticos. Las biopelículas protegen a las bacterias de los antibióticos, lo que resulta en una infección implacable. La miel actúa como un negociador bactericida, penetra en las biopelículas, recupera la infección agresiva y erradica las colonias [ 66 , 67 ]. Ha demostrado un efecto bactericida contra biopelículas de cepas de referencia patógenas como Staphylococcus epidermidis resistente a la meticilina (MRSE), betalactamasas de espectro extendido (ESBL), Klebsiella pneumonia , Pseudomonas aeruginosa , Staphylococcus aureus (SA), Proteus mirabilis , Pseudomonas aeruginosa (PA), Clostridium difficile y E. coli enterohemorrágica . Mejora la cicatrización de heridas, previene infecciones invasivas, elimina la colonización de biopelículas, interrumpe los brotes y, por lo tanto, preserva las reservas actuales de antibióticos [ 66 , 68-70 ] . Inhibe el crecimiento de biopelículas al prevenir la unión de cepas bacterianas con fibronectina tisular en el sitio de la infección. También reduce la expresión de proteínas de superficie de unión a fibronectina como Sfb1 y Sof, que son cruciales para que las bacterias se unan a la fibronectina [ 71 ]. También suprime significativamente la expresión de genes de detección de quórum (importador AI-2 y biosíntesis de indol), genes curli (csgBAC) y genes de virulencia (genes LEE) en E. coli virulenta . El contenido de glucosa y fructosa en la miel se consideró componentes clave en la represión de la formación de biopelículas [ 72 ].
La cicatrización normal de heridas es un proceso de varias partes en el que ocurren series coincidentes de eventos que incluyen coagulación, inflamación, proliferación celular, remodelación tisular y reemplazo de tejido dañado [ 73 ]. La miel se ha utilizado ampliamente para el tratamiento de varios tipos de heridas crónicas, quemaduras, necróticas, pie diabético y piel abierta postoperatoria [ 61 , 74 – 76 ]. En la fase inflamatoria de la cicatrización de heridas, la miel ayuda a la eliminación de tejidos necróticos [ 63 ], mejora la fase de remodelación [ 63 ] e inhibe el crecimiento bacteriano [ 59 ], lo que resulta en una mejor cicatrización. Un estudio reciente indica un aumento de la producción de IL-6 y TNF- α por la miel en el sitio de la herida en el proceso de curación en ratones deficientes en IL-6 [ 77 ]. La miel facilita una mayor estimulación y producción de linfocitos, fagocitos, monocitos y/o macrófagos para liberar citocinas e interleucinas como TNF- α , IL-1β e IL-6, acelerando el proceso de curación [ 78 ]. Los altos contenidos de azúcar y la osmolaridad de la miel también contribuyen a la curación. El agua se extrae del lecho de la herida por el efecto osmótico de la miel a través de un simple flujo de salida de linfa si la circulación sanguínea en el sitio de la herida es suficiente para llevar a cabo este proceso [ 79 ]. La investigación ha demostrado que la miel mejora la curación de heridas a través de la respuesta antioxidante al activar AMPK (proteína quinasa activada por 5'adenosina monofosfato) y enzimas antioxidantes que mejoran el estrés oxidativo. El sistema antioxidante comprende antioxidantes exógenos y endógenos. Los antioxidantes endógenos se clasifican como antioxidantes enzimáticos y no enzimáticos. Los antioxidantes enzimáticos incluyen la superóxido dismutasa (SOD), la catalasa (CAT) y la glutatión peroxidasa (GPx). Los antioxidantes no enzimáticos comprenden las vitaminas E y C, el glutatión (GSH) y algunas moléculas pequeñas, mientras que los antioxidantes exógenos incluyen algunos micronutrientes [ 24 , 80 ]. Estos antioxidantes también apoyan la proliferación y migración de fibroblastos dérmicos humanos y la función mitocondrial para ayudar a la curación [ 81 ].
Otro mecanismo explica que los sitios de la herida tengan usualmente dos tipos de enzimas que digieren proteínas: serina proteasas y metaloproteasas de matriz. Estas enzimas proteasas son generalmente inactivas debido a la presencia de algunos inhibidores. Las proteasas se activan cuando los inhibidores se vuelven inactivos por H 2 O 2 . Por lo tanto, H 2 O 2 juega un papel como estímulos de conmutación fisiológica para la activación e inactivación de estas enzimas a través de la oxidación. Se ha informado que la miel estimula y mejora la producción de H 2 O 2 . Los restos de la herida y las bacterias son digeridos por proteasas activas. El efecto activo de la miel barre estos restos fácilmente debido al flujo de salida osmótico [ 7 , 82 ]. Durante la inflamación, H 2 O 2 también estimula el crecimiento de fibroblastos y células epiteliales para reparar el daño. De manera similar, H 2 O 2 estimula los factores de transcripción nuclear (NTF) para la multiplicación celular y la cicatrización de heridas [ 7 ].
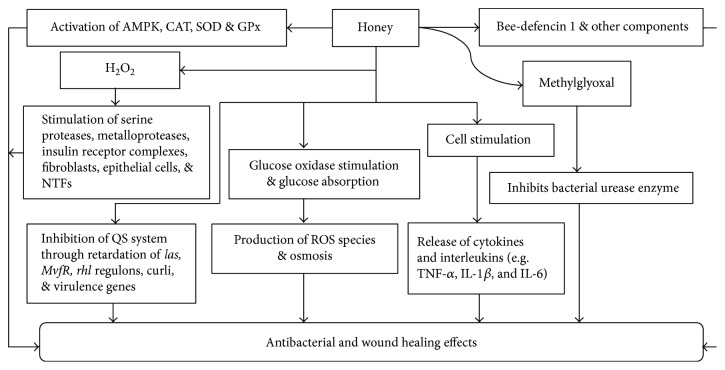
Algunos mecanismos adicionales detallan que el H 2 O 2 estimula los complejos del receptor de insulina para desencadenar una cadena de eventos moleculares en la célula. Esto facilita la absorción de aminoácidos y glucosa para el crecimiento celular. La miel en sí puede proporcionar vitaminas, minerales, azúcares y aminoácidos a las células en crecimiento. Esto ayuda a los fagocitos a engullir bacterias infecciosas a través del consumo de glucosa. La miel también estimula la liberación de citocinas de la proliferación de monocitos y linfocitos para reparar los tejidos. La activación de los monocitos por mitógenos o miel conduce a la producción de especies reactivas de oxígeno para iniciar una mayor respuesta inflamatoria. Provoca edema en el tejido circundante restringiendo la circulación en los capilares. Esto da como resultado la reducción del suministro de oxígeno y nutrientes a las células. En última instancia, restringe el crecimiento celular para reemplazar los tejidos para reparar las heridas [ 7 , 83 ]. Todos los posibles mecanismos involucrados en los efectos antibacterianos y de curación de heridas de la miel se han demostrado en la Figura 4 .
Figura 4.
Mecanismos de los efectos antibacterianos y cicatrizantes de la miel. AMPK = proteína quinasa activada por 5′adenosina monofosfato; QS = detección de quórum; SOD = superóxido dismutasa; GPx = glutatión peroxidasa; NTFs = factores de transcripción nuclear; TNF- α = factor de necrosis tumoral alfa; IL = interleucinas.
2.3 Efectos antifúngicos de la miel
La miel exhibe actividad antifúngica. La investigación ha demostrado que tiene actividad antifúngica contra Aspergillus niger , Aspergillus flavus , Penicillium chrysogenum , Microsporum gypseum , Candida albicans , Saccharomyces y especies de Malassezia [ 84 ]. El posible efecto antimicrobiano de la miel se atribuye a la presencia de glucosa oxidasa, metilglioxal y altos contenidos de azúcar [ 85 – 88 ]. El mecanismo no se entiende completamente; sin embargo, se han sugerido algunas vías potenciales.
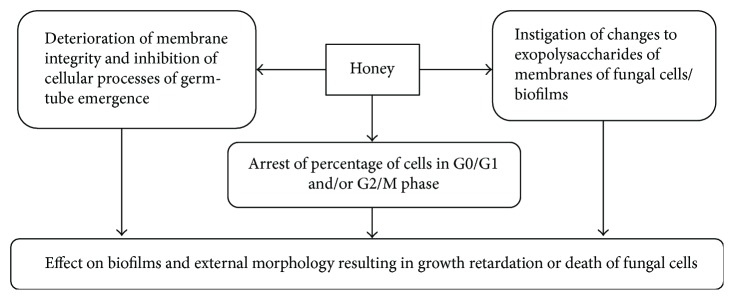
La miel inhibe el crecimiento de hongos al prevenir la formación de biopelículas, alterar las biopelículas establecidas e instigar cambios en la estructura del exopolisacárido. Distorsiona la integridad de la membrana celular, lo que da como resultado la contracción de la superficie celular en la biopelícula, lo que lleva a la muerte o al retraso del crecimiento [ 89 ]. Los estudios microscópicos de fuerza atómica han revelado que cuando la biopelícula se trata con miel (40% p / v ), el espesor de la capa de exopolisacárido se reduce a la mitad y la rugosidad aumenta, seguido de su eliminación completa [ 90 ]. Los investigadores han demostrado que la parte flavonoide de la miel desacelera el crecimiento de los hongos, afecta la morfología externa y la integridad de la membrana e inhibe algunos procesos celulares que están involucrados en el crecimiento del tubo germinativo. La inhibición de la emergencia del tubo germinativo se correlaciona con un crecimiento deficiente de la membrana. También se ha descubierto que el extracto de flavonoides de miel afecta la transición hifal al reducir el porcentaje de células en la fase G0/G1 y/o la fase G2/M [ 91 ]. La figura 5 muestra los posibles mecanismos implicados en los efectos antifúngicos de la miel. La descripción detallada de los efectos antifúngicos de la miel y los objetivos moleculares implicados es una laguna clave que aún queda por investigar.
Figura 5.
Mecanismos de los efectos antifúngicos de la miel.
2.4. Efectos antivirales de la miel
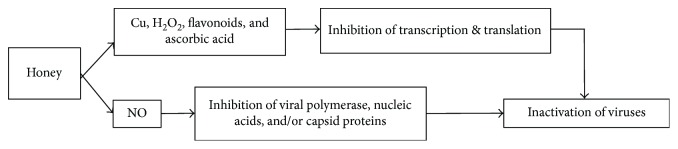
La actividad viral es usualmente provocada por estímulos nativos o universales que conducen a infecciones y lesiones [ 92 ]. Estudios actuales han manifestado que la miel tiene efectos antivirales potenciales. El efecto antiviral de la miel se atribuye a sus varios ingredientes que han sido encontrados como operativos en el control de lesiones, por ejemplo, el cobre inactiva el virus que es un oligoelemento parte de la miel. De manera similar, la presencia de ácido ascórbico, flavonoides y producción de H2O2 por la miel también conduce a la inhibición del crecimiento viral al interrumpir la transcripción y traducción viral [ 93 , 94 ] . Datos de estudios in vitro han demostrado actividad antiviral de la miel contra diferentes tipos de virus tales como rubéola , herpes simple y varicela zóster [ 31 , 95 , 96 ]. La miel comprende secreción de las glándulas salivales y faríngeas de la cabeza de la abeja. Recientemente, se han identificado metabolitos de óxido nítrico (NO), nitrito y nitrato en la sección de la glándula salival [ 56 ]. Está bien establecido que el NO es una molécula energética que produce defensa del huésped contra los virus, tanto de ADN como de ARN. El NO actúa ralentizando el desarrollo de las lesiones virales y deteniendo su replicación [ 56 , 97 ]. En su modo de acción, el NO reprime la replicación interfiriendo con la polimerasa viral, el ácido nucleico y/o las proteínas de la cápside viral. También se ha informado que el contenido de flavonoides de la miel inhibe la transcripción y replicación viral [ 98 , 99 ]. La Figura 6 presenta los posibles mecanismos involucrados en la actividad antiviral de la miel. Para comprender la influencia real de la miel en los virus y los mecanismos, se pretende realizar más investigaciones para trazar el camino.
Figura 6.
Mecanismos de los efectos antivirales de la miel. Cu = cobre; NO = óxido nítrico.
2.5 Efectos antiinflamatorios de la miel
La inflamación es la respuesta biológica compleja de los tejidos vasculares a los estímulos perjudiciales. Es una forma defensiva de respuesta que muestran los tejidos y el organismo para eliminar los patógenos o estímulos que son la causa de la lesión. La inflamación se clasifica en dos clases: inflamación aguda y crónica. La inflamación aguda es una respuesta temprana del cuerpo a los estímulos. La indicación de la inflamación aguda es enrojecimiento, dolor, picazón y pérdida de la capacidad para realizar la función [ 100 ]. Si la inflamación aguda no se trata bien y se prolonga, se convierte en inflamación crónica. Se considera como una causa importante de varias enfermedades o trastornos crónicos. Por lo tanto, se supone que la acción antiinflamatoria contrarresta enfermedades incesantes como las enfermedades del hígado [ 101 ], las enfermedades renales [ 102 ] y el cáncer [ 103 ]. Varios factores pueden intervenir en la respuesta proinflamatoria, como las citocinas, las ciclooxigenasas (COX), las lipoxigenasas (LOX), los mitógenos, los macrófagos, los factores TNF y muchos otros factores de las vías inflamatorias.
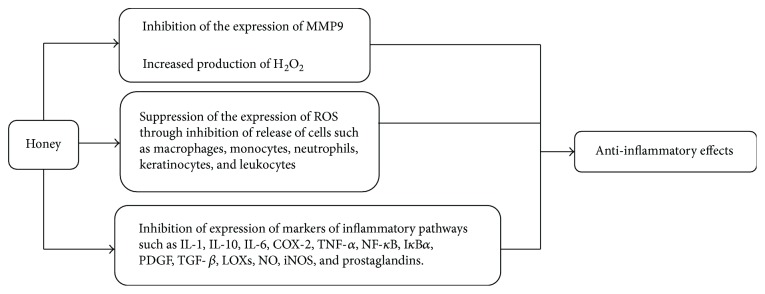
La acción antiinflamatoria de la miel está bien documentada [ 104 ]. Se ha demostrado una respuesta antiinflamatoria desde cultivos celulares [ 40 ], modelos animales y ensayos clínicos [ 104 , 105 ]. El mecanismo exacto de acción de la miel hacia la inflamación aún no se entiende bien. En la vía inflamatoria, dos de sus componentes activados en las dolencias son la proteína quinasa activada por mitógenos (MAPK) y las vías del factor nuclear kappa B (NF- κ B) [ 120 ]. La activación de MAPK y NF- κ B finalmente resulta en la inducción de varios otros mediadores inflamatorios, enzimas, citocinas, proteínas y genes como la ciclooxigenasa-2 (COX-2), la lipoxigenasa 2 (LOX-2), la proteína C reactiva (PCR), las interleucinas (IL-1, IL-6 e IL-10) y el TNF- α . Se sabe que todos estos marcadores de acción proinflamatoria desempeñan un papel importante en la inflamación y la etiología relacionada con la angiogénesis de la enfermedad [ 30 , 119 ]. Evidencia reciente de estudios in vivo ha demostrado los mecanismos antiinflamatorios de la miel. Estos estudios mostraron que la miel disminuye el edema y los niveles plasmáticos de citocinas proinflamatorias como IL-6, TNF- α , PGE2, NO, iNOS y COX-2. También se demostró que la miel atenúa la translocación de NF- κB al núcleo y suprime la degradación de IκBα ( inhibidor de kappaB) [ 106 , 107 ]. Se ha informado que los ácidos fenólicos y flavonoides como la crisina, la quercetina y la galangina pueden suprimir la actividad de las enzimas proinflamatorias, por ejemplo, la ciclooxigenasa-2 (COX-2), las prostaglandinas [ 108 ] y la óxido nítrico sintasa inducible (iNO) [ 109 ]. La investigación ha demostrado que el contenido de flavonoides de la miel ralentiza la expresión de MMP-9 (metalopeptidasa de matriz 9), un mediador inflamatorio que causa inflamación crónica. La miel tiene la capacidad de inhibir significativamente la expresión de citocinas antiinflamatorias como IL-1 e IL-10 y los factores de crecimiento PDGF (factor de crecimiento derivado de plaquetas) y TGF- β (factor de crecimiento transformante -β ). Se concluyó el modelo in vitro de líneas celulares MM6 utilizando una solución de miel al 1% [ 110 ]. Otro posible mecanismo muestra que las especies reactivas de oxígeno son producidas por macrófagos, monocitos y neutrófilos que aumentan la inflamación. La miel detiene la liberación de este tipo de células para promover el efecto antiinflamatorio. También inhibe la producción de queratinocitos y leucocitos para reducir la inflamación. Se ha demostrado que en la respuesta inflamatoria el H 2 O 2La producción de miel estimula el crecimiento de fibroblastos y células epiteliales para reparar el daño inflamatorio. Esta acción antiinflamatoria de la miel la convierte en un nuevo agente para modular una enfermedad [ 111 – 113 ].
El metabolismo anómalo del ácido araquidónico está involucrado en la inflamación. Las LOX metabolizan el ácido araquidónico a leucotrienos (LT). Hay tres tipos de isoenzimas de lipoxigenasa (LOX): 12-LOX, 15-LOX y 5-LOX. 12-LOX provoca trastornos inflamatorios/alérgicos, 15-LOX sintetiza 15-HETE (ácido 15-hidroxieicosatetraenoico) antiinflamatorio, y 5-LOX genera 5-HETE (ácido 5-hidroxieicosatetraenoico) y LT [ 114 ]. Se ha informado que muchos polifenoles en la miel suprimen las LOX [ 114 ]. El efecto antiinflamatorio de la miel se puede atribuir a sus compuestos fenólicos y flavonoides [ 15 , 128 , 129 ]. La Figura 7 representa los posibles mecanismos del efecto antiinflamatorio de la miel. Para comprender la influencia real de la miel en las vías de señalización de LOX, COX y TNF y los mecanismos involucrados, se pretende realizar más investigaciones para trazar el camino.
Figura 7.
Mecanismos de los efectos antiinflamatorios de la miel. MMP-9 = metalopeptidasa de matriz 9; IL = interleucina; COX-2 = ciclooxigenasa 2; LOXs = lipoxigenasas; TNF- α = factor de necrosis tumoral alfa; PGE2 = prostaglandina E2; NO = óxido nítrico; iNOS = óxido nítrico sintasa inducible; NF- κ B = factor nuclear kappa B; I κ B α = inhibidor de kappa B; PDGF = factor de crecimiento derivado de plaquetas; TGF- β = factor de crecimiento transformante β .
2.6 La miel y sus propiedades antidiabéticas
La diabetes mellitus es un síndrome metabólico complejo, que se debe a una deficiencia de insulina o a una insulina no funcional [ 115 ]. En este síndrome intervienen muchas anomalías en el metabolismo de las lipoproteínas y los carbohidratos, con un nivel elevado de glucosa [ 116 , 117 ]. Las complicaciones agudas de este trastorno pueden incluir hiperosmolaridad, cetoacidosis diabética y estado hiperglucémico, que puede conducir a la muerte [ 118 ].
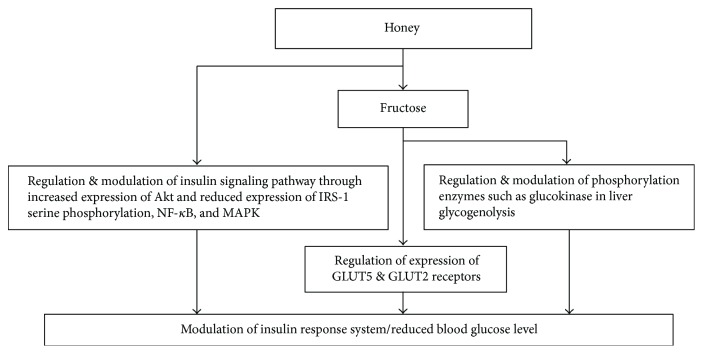
La miel ha demostrado efectos antidiabéticos desde modelos animales hasta ensayos clínicos [ 30 , 119 ]. Los investigadores la han invocado como un agente antidiabético potencial [ 120 ]. Sus concentraciones probadas, como 0,2, 1,2 y 2,4 g/kg/día, mostraron un efecto antioxidante mejorado que ejerce un efecto hipoglucémico en ratas diabéticas inducidas con estreptozotocina [ 30 ]. De manera similar, se encontró que el nivel de glucosa en la diabetes mellitus tipo 2 se reducía cuando se administraba miel por inhalación al 60% ( P / V ) [ 119 ]. Este efecto antidiabético o hipoglucémico de la miel se atribuye a la presencia de fructosa en ella [ 122 ]. La fructosa ayuda a regular el sistema de respuesta a la insulina, lo que resulta en un nivel de glucosa en sangre controlado. Otra hipótesis sugiere que el nivel de glucosa se reduce por el aplazamiento de la digestión y la absorción que son provocadas por el oligosacárido palatinosa, una sacarosa. Esto resulta en la modulación de la diabetes en pacientes diabéticos [ 123 ]. También se ha informado que la captación de glucosa en las células puede aumentarse en colaboración con la fructosa [ 124 , 125 ], lo que lleva a una disminución de la ingesta o absorción de alimentos para dirigir un efecto hipoglucémico. Los monosacáridos como la glucosa, la fructosa y la galactosa se forman por la hidrólisis de los carbohidratos antes de su absorción [ 126 ]. Se ha sugerido que la fructosa es absorbida por los dos receptores GLUT5 y/o GLUT2 a través de la difusión mediada por proteínas y energía [ 127 ]. La expresión del ARNm de GLUT2 generalmente aumenta con la glucosa y la fructosa. Sin embargo, una mayor expresión del ARNm de GLUT5 es causada únicamente por la fructosa, lo que resulta en su rápida absorción [ 128 – 130 ]. La investigación ha demostrado que se observó un efecto hipoglucémico cuando los ratones inducidos con diabetes fueron alimentados con fructosa [ 131 ]. El nivel de glucosa también puede ser regulado por una función hipoglucemiante específica de la fructosa en el hígado. En este modo de acción, la fructosa estimula las enzimas de fosforilación, por ejemplo, la glucoquinasa, desencadenando la fosforilación hepática de la glucosa [ 132 ]. La inhibición de estas enzimas da como resultado la inhibición de la glucogenólisis. Por lo tanto, todo el metabolismo del glucógeno y la glucosa está regulado por la fructosa, mostrando su papel regulador vital para controlar la hiperglucemia [ 133 , 134 ].
Otro mecanismo propuesto explica que el efecto hipoglucémico de la miel puede ser a través del papel de la miel en la modulación de la vía de señalización de la insulina [ 120 , 135 ]. Un componente clave de la señalización de la insulina es el PI3K/Akt [ 136 ]. Es conocido por su papel en las funciones moduladoras de varios sustratos que regulan la progresión del ciclo celular, la supervivencia celular y el crecimiento celular. El efecto de los extractos de miel en la vía de señalización de la insulina activada por Akt en las células pancreáticas se investigó recientemente en condiciones de hiperglucemia. Se observó que el desarrollo de la resistencia a la insulina se caracterizó por un aumento de los niveles de NF- κ B, MAPK y la fosforilación de serina del sustrato del receptor de insulina 1 (IRS-1). Se encontró que la expresión de Akt y los contenidos de insulina se redujeron notablemente. Este estudio mostró que el pretratamiento con miel y extracto de quercetina mejora la resistencia a la insulina y los contenidos de insulina. El tratamiento con miel aumentó la expresión de Akt y redujo la expresión de la fosforilación de serina IRS-1, NF- κ B y MAPK [ 120 , 135 – 137 ].
La suplementación con miel muestra sus efectos moduladores sobre el estrés oxidativo y la hiperglucemia. Su actividad antioxidante para mejorar la diabetes está bien establecida [ 24 ]. Además de esto, también mejora varios otros trastornos metabólicos observados en la diabetes, como niveles reducidos de triglicéridos, transaminasas hepáticas, hemoglobina glicosilada (HbA1c) y colesterol HDL aumentado [ 138 ]. La Figura 8 muestra los posibles mecanismos de los efectos antidiabéticos de la miel. Se justifican más estudios para explorar los mecanismos exactos involucrados en la actividad antidiabética de la miel.
Figura 8.
Mecanismos de los efectos antidiabéticos de la miel. MAPK = proteína quinasa activada por mitógeno; NF- κ B = factor nuclear kappa B; Akt = PI3 quinasa alterada; IRS-1 = sustrato 1 del receptor de insulina.
2.7 Efectos antimutagénicos de la miel
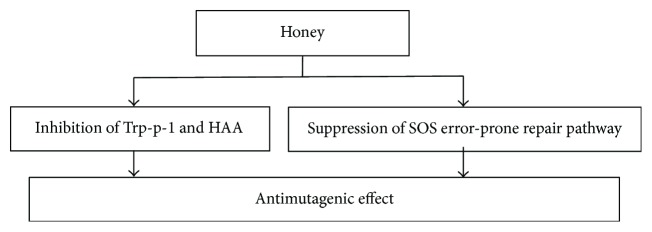
La mutagenicidad, la capacidad de inducir mutaciones genéticas, está interrelacionada con la carcinogenicidad [ 139 ]. La miel exhibe una fuerte actividad antimutagénica [ 140 ]. Se investigó el efecto de la miel sobre las células de Escherichia coli expuestas a la radiación (UV o γ ) para observar la respuesta SOS, que es una vía de reparación propensa a errores que contribuye a la mutagenicidad [ 140 ]. Algunos genes importantes como umuC , recA y umuD involucrados en la mutagénesis mediada por SOS fueron eliminados para elaborar los resultados. La miel redujo la frecuencia de mutación significativamente en los grupos de tratamiento que en los controles. La supresión de las vías de reparación mutagénicas propensas a errores (por ejemplo, la respuesta SOS en E. coli ) fue el posible mecanismo que contribuyó al efecto antimutagénico. La actividad antimutagénica de la miel de siete fuentes florales diferentes (acacia, trigo sarraceno, epilobio, soja, tupelo y baya de Navidad) y el análogo de azúcar de miel contra Trp-p-1 se probó mediante el ensayo de Ames [ 28 ]. Todas las mieles mostraron una inhibición significativa de la mutagenicidad causada por Trp-p-1. Aproximadamente el 30% de miel en la formulación de infusión fue más eficaz para inhibir la formación de HAA (aminas aromáticas heterocíclicas) y la mutagenicidad general en filetes de res y pechuga de pollo [ 141 ]. La Figura 9 muestra los posibles mecanismos de los efectos antimutagénicos de la miel. Se necesita una investigación de amplio espectro para comprender los mecanismos de los efectos antimutagénicos de la miel.
Figura 9.
Mecanismos de los efectos antimutagénicos de la miel. Trp = triptófano; HAA = aminas aromáticas heterocíclicas; SOS = respuesta de una vía de reparación propensa a errores que contribuye a la mutagenicidad.
2.8. Efectos anticancerígenos de la miel
Las células cancerosas poseen dos características distintivas: multiplicación celular desenfrenada y recambio apoptótico inadecuado [ 142 ]. Los fármacos que se utilizan habitualmente para el tratamiento del cáncer son los inductores de apoptosis [ 143 ]. La muerte celular programada o apoptosis se clasifica en tres fases: (a) una fase de inducción, (b) una fase efectora y (c) una fase de degradación. La fase de inducción estimula cascadas de transducción de señales proapoptóticas a través de señales inductoras de muerte (señalización de ceramida, especies reactivas de oxígeno, proteínas de la familia Bcl-2 como Bad, Bax y Bid, y sobreactivación de la vía de señalización de Ca 2+ ). La fase efectora se encarga de provocar la muerte celular a través de un regulador clave, la mitocondria. La última fase de degradación comprende eventos nucleares y citoplasmáticos. El cambio nuclear incluye condensación nuclear y de cromatina, encogimiento celular, fragmentación de ADN y formación de ampollas en la membrana. En el citoplasma, se activa una cascada compleja de enzimas que escinden proteínas llamadas caspasas. La célula finalmente se destina a cuerpos apoptóticos fragmentados, que son fagocitados por macrófagos u otras células circundantes [ 143 , 144 ].
La apoptosis generalmente sigue dos vías: la vía de la caspasa-8 o del receptor de muerte y la vía de la caspasa-9 o mitocondrial.
La literatura ha establecido que la miel induce apoptosis en varios tipos de células cancerosas [ 22 , 39 , 40 , 145 , 146 ]. Este temperamento apoptótico de la miel es vital porque muchos fármacos utilizados para el tratamiento del cáncer son inductores de apoptosis [ 147 ]. Por lo tanto, la miel y sus componentes activos pueden regular la apoptosis al operar en varios puntos de estas dos vías de señalización.
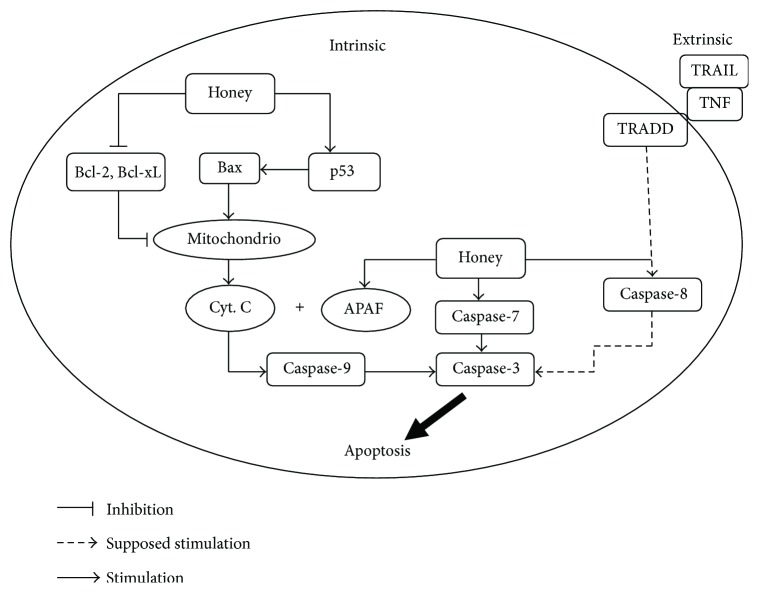
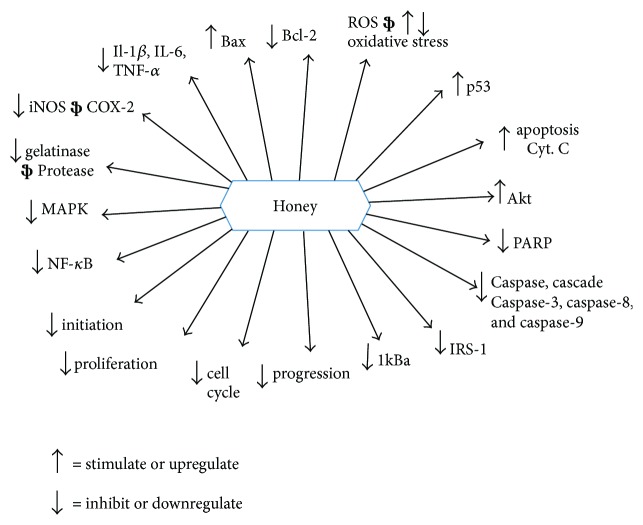
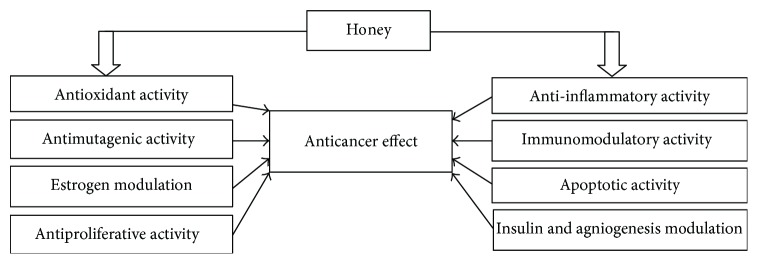
La miel induce la apoptosis en líneas celulares de cáncer de mama, colon y cuello uterino humano mediante la despolarización de la membrana mitocondrial al reducir el potencial de membrana mitocondrial [ 22 , 39 ]. Estos estudios demostraron la inducción apoptótica de la vía de la caspasa-9 por la miel. Otra investigación investigó que la miel cruda era la única responsable de inducir la apoptosis en líneas celulares de cáncer de colon humano y glioma C6 al elevar el nivel de activación de la caspasa-3 y la escisión de PARP ( poli (ADP-ribosa) polimerasa ). Esta característica se atribuyó a mayores contenidos de triptófano y fenólicos de la miel [ 40 , 145 , 148 ]. Los investigadores demostraron que induce la apoptosis al regular positivamente y modular la expresión de proteínas pro- y antiapoptóticas en las líneas celulares de cáncer de colon HCT-15 y HT-29. Se encontró que elevaba la expresión de la caspasa-3, p53 y la proteína proapoptótica Bax. Reguló a la baja la expresión de la proteína antiapoptótica Bcl-2. Todo el mecanismo explicó que la generación de ROS por la miel da como resultado la activación de p53, que a su vez modula la expresión de proteínas pro o antiapoptóticas como Bax y Bcl-2 [ 22 ]. Se encontró que la miel administrada con Aloe vera aumenta la expresión de la proteína proapoptótica Bax y disminuye la expresión de la proteína antiapoptótica Bcl-2 en ratas Wistar con implantes de carcinoma mamario W256 [ 147 , 148 ]. Además, dos estudios diferentes demostraron que la miel ejerce sus efectos terapéuticos y preventivos del cáncer de múltiples formas, como la modulación de la respuesta inmune al mejorar los parámetros hematológicos y la estimulación de la vía apoptótica intrínseca/mitocondrial a nivel serológico y de tejido canceroso. En estos estudios, se administró miel por vía oral al modelo de rata Sprague-Dawley utilizando diferentes concentraciones, como 0,2, 1,0 y 2,0 g/kg de peso corporal. Mejoró la vía apoptótica intrínseca a través de la regulación positiva de la expresión de proteínas proapoptóticas como caspasa-9, APAF-1 (factor activador de proteasa apoptótica 1), p53, IFN- γ (interferón gamma) e IFNGR1 (receptor de interferón gamma 1). Al mismo tiempo, se encontró que la miel regulaba negativamente la expresión de proteínas antiapoptóticas como Bcl-xL (linfoma de células B extra grande), TNF- α , COX-2, E2 (estrógeno) y ESR1 (receptor de estrógeno 1) [ 149 , 150 ]. También se demostró que la miel sola induce la vía apoptótica intrínseca o de la caspasa-9 sin evidencia de la participación de la vía extrínseca o de la caspasa-8 [ 149 , 150 ]. Se ha descubierto que los flavonoides y los contenidos fenólicos de la miel ocluyen el ciclo celular del glioma [ 145 ] y el melanoma [146 ], colon [ 40 ] y líneas celulares cancerosas en fase G0/G1. Este efecto inhibidor sobre la proliferación de células tumorales sigue la regulación negativa de muchas vías celulares a través de la tirosina ciclooxigenasa, la ornitina descarboxilasa y la quinasa [ 40 , 145 , 146 , 151 ]. Los mecanismos de acción de la miel incluyen principalmente su interferencia con múltiples dianas moleculares y vías de señalización celular como las vías apoptóticas, antiproliferativas o de arresto del ciclo celular, antiinflamatorias, moduladoras estrogénicas, antimutagénicas, moduladoras de insulina, moduladoras de angiogénesis e inmunomoduladoras [ 6 , 17 ]. Las revisiones de Ahmed et al. [ 6 ] y Erejuwa et al. [ 17 ] han explicado bien los posibles mecanismos de los efectos anticancerígenos de la miel. Las figuras 10 , 11 y 12 muestran una presentación resumida de los mecanismos de los efectos anticancerígenos de la miel. Se necesitan más estudios para comprender la influencia exacta de la miel en las vías apoptóticas en las células cancerosas, como la activación de la caspasa-8, p21, p38 MAPK (vías de la proteína quinasa asociada a mitógeno y p38), p-38 JNK (quinasa N-terminal c-Jun), la liberación de citocromo c y la supresión de proteínas antiapoptóticas como IAP (proteínas inhibidoras de la apoptosis), c-FLIP (proteína inhibidora celular de Flice) y Akt (quinasa PI3 alterada), y la iniciación de la vía extrínseca de la apoptosis por inducción de TRAIL (ligando inductor de apoptosis relacionado con TNF) y estimulación del receptor Fas (proteína asociada a la sintasa de ácidos grasos) en células cancerosas.
Figura 10.
Efecto de la miel sobre las vías apoptóticas (adoptado de [ 6 ]). Bcl-2 = linfoma de células B 2; Bcl-xL = linfoma de células B extra grande; Cyt. C = citocromo C; APAF-1 = factor activador de la proteasa apoptótica 1; TNF = factor de necrosis tumoral; TRAIL = ligando inductor de apoptosis relacionado con TNF; TRADD = proteína del dominio de muerte asociada a TNFR.
Figura 11.
Modulación de dianas moleculares: los efectos anticancerígenos de la miel (adoptado de [ 17 ]). Bcl-2 = linfoma de células B 2; Bcl-xL = linfoma de células B extra grande; Cyt. C = citocromo C; MAPK = proteína quinasa activada por mitógeno; NF- κ B = factor nuclear kappa B; Akt = PI3 quinasa alterada; IRS-1 = sustrato del receptor de insulina; IL = interleucina; COX-2 = ciclooxigenasa 2; TNF- α = factor de necrosis tumoral alfa; iNOS = óxido nítrico sintasa inducible; I κ B α = inhibidor de kappa B; PARP = poli ADP-ribosa polimerasa.
Figura 12.
Resumen esquemático de los efectos anticancerígenos de la miel (adoptado de [ 6 ]).
2.9. Efectos antiproliferativos de la miel
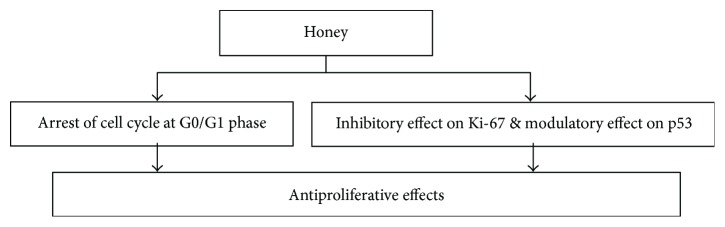
La célula se divide en dos durante el ciclo celular para reemplazar la muerte celular. El ciclo celular comprende tres fases distinguidas conocidas como G0, G1, S y G2/M. Las células permanecen en la fase G0 y no participan en la división celular. La célula se prepara en la fase G1 para avanzar a través de la división celular, y la fase S implica la síntesis de ADN. Las fases G2 y M están listas para la mitosis con ADN 4n. Todos los eventos en el ciclo celular están regulados y monitoreados por varias proteínas diferentes. El panel de control del ciclo celular comprende ciclinas y quinasas dependientes de ciclina. La transición de fase G1/S es un punto regulador vital, donde el destino de la célula está destinado a la quiescencia, proliferación, diferenciación y apoptosis. La sobreexpresión y desregulación de los factores de crecimiento del ciclo celular como la ciclina D1 y las quinasas dependientes de ciclina (CDK) están vinculadas con la patogénesis. La pérdida de esta regulación es también el sello distintivo del cáncer [ 152 ]. La proteína nuclear Ki-67 es un nuevo marcador para investigar la fracción de crecimiento de la proliferación celular. Está ausente en la fase de reposo (G0), pero se expresa durante el ciclo celular en todas las fases de proliferación (G1, S, G2 y mitosis) durante el ciclo celular [ 153 ].
La administración de miel y solución de Aloe vera mostró una marcada disminución en la expresión de Ki67-LI en células tumorales en ratas Wistar que tenían 256 carcinomas [ 147 ]. Se informa que la miel y sus diversos componentes como flavonoides y fenólicos bloquean el ciclo celular de las líneas celulares de cáncer de colon en la fase G0/G1 [ 40 ]. Este efecto inhibidor sobre la proliferación de células tumorales sigue la regulación negativa de muchas vías celulares a través de proteínas como la tirosina ciclooxigenasa, la ornitina descarboxilasa y la quinasa. Por lo tanto, se puede plantear la hipótesis de que la miel, o sus componentes, median la inhibición del crecimiento celular y se deben a la perturbación en el ciclo celular que posiblemente pueda conducir a la apoptosis [ 40 , 145 , 146 , 154 ]. El ciclo celular es un proceso regulado también por la proteína p53, que como resultado del daño del ADN aumenta los niveles de inhibidores de la quinasa dependiente de ciclina (Cdk) como las proteínas p21, p16 y p27 [ 22 ]. Se informa que la miel está involucrada en la modulación de la regulación de p53 en líneas celulares de cáncer de colon [ 22 ]. La Figura 13 representa los posibles mecanismos de los efectos antiproliferativos de la miel. La miel puede suprimir y/o bloquear la división anormal de células al actuar en varios puntos del ciclo celular. Esto todavía urge a investigar el efecto de la miel en los niveles de quinasas dependientes de ciclina, complejos de ciclinas, quinasas de proteína dependientes de ciclina e inhibidores de quinasas dependientes de ciclina como las proteínas p16, p21 y p27 en la proliferación del ciclo celular.
Figura 13.
Mecanismos de los efectos antiproliferativos de la miel.
2.10. Efectos inmunomoduladores de la miel
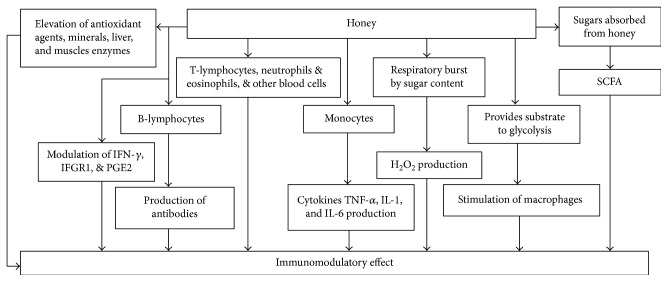
La inmunomodulación es la progresión de la alteración de un sistema inmunológico en un estilo constructivo o dañino. Muchas mezclas biológicas y químicas tienen la capacidad de modificar el sistema inmunológico [ 155 ]. Las citocinas inmunomoduladoras como TNF- α , IL-1, IL-6 e IL-10 estimulan la activación y proliferación de células sanguíneas para inducir la actividad fagocítica y linfocítica, lo que desencadena una respuesta inmunomoduladora [ 156 ]. Se descubrió que la miel provoca estimulación del sistema inmunológico del cuerpo para combatir infecciones en ratas. Estimula los linfocitos T, los linfocitos B y los neutrófilos en cultivos celulares. Los linfocitos B finalmente estimulan la producción de anticuerpos en respuestas inmunes primarias y secundarias contra antígenos dependientes e independientes del timo [ 157 ]. Estimula a los monocitos para que liberen citocinas como TNF- α , IL-1 e IL-6, activando numerosos aspectos de la respuesta inmune. La acción estimulante de la miel sobre los leucocitos ilustra otra acción llamada “estallido respiratorio”. En esta acción, la glucosa de la miel se absorbe para producir H2O2 , que se considera un componente principal para estimular el sistema inmunológico. También suministra sustrato a la glucólisis para producir energía en los macrófagos y permitirles realizar una función inmunomoduladora [ 4 , 158 ].
Las investigaciones han demostrado que los azúcares que se absorben lentamente dan lugar a la formación de productos de fermentación de ácidos grasos de cadena corta (AGCC). Es un mecanismo probable que la ingestión de miel pueda dar lugar a la formación de AGCC. Se ha establecido que, ya sea directa o indirectamente, los AGCC tienen acciones inmunomoduladoras. Por tanto, la miel puede estimular el sistema inmunológico a través de estos azúcares fermentables [ 159 ]. Se ha descubierto que un azúcar, la nigerosa, presente en la miel es inmunoprotector [ 160 ]. Los componentes no azucarados de la miel también pueden ser responsables de la inmunomodulación. El contenido antioxidante de la miel también contribuye a la acción inmunomoduladora. Aunque se ha informado de que los compuestos antioxidantes estimulan la función inmunológica in vitro , no existen estudios directos que manifiesten los efectos de los antioxidantes de la miel en el sistema inmunológico [ 159 , 160 ]. Diferentes estudios presentaron que las mieles de Manuka, Pastura, Selva Nigeriana y jalea real utilizadas en concentraciones variantes aumentaron la producción de IL-1 β , IL-6 y TNF- α, apalbúmina 1, en modelos de líneas celulares [ 35 , 78 , 161 ]. El componente activo en Manuka fue de 5,8 kDa, que aumentó la producción de estas citocinas y TNF- α a través de TLR4 (receptor tipo toll-4) en el cultivo de líneas celulares. Estos autores establecieron que el compuesto no era un aminoácido, lipopolisacárido, mineral o vitamina, lo que insta a investigar la naturaleza de este compuesto inmunorregulador [ 78 ]. El tratamiento con miel (0,2, 1,0 y 2,0 kg/kg) mostró un efecto potenciador sobre parámetros hematológicos como Hb, RBC, PCV, linfocitos y eosinófilos. También mostró un efecto creciente sobre IFN- γ e IFNGR1 a nivel sérico y de tejido canceroso en ratas inducidas con cáncer de mama [ 149 , 150 ]. Se encontró que la miel, cuando se probó usando una concentración de 1,2 g/kg de peso corporal, aumentaba los agentes antioxidantes (vitamina C y β -caroteno), monocitos, linfocitos, eosinófilos, hierro y cobre séricos, glutatión reductasa y oligoelementos (Zn y Mg) en sujetos humanos sanos. Causó una disminución de la inmunoglobulina E, ferritina y enzimas hepáticas y musculares, aspartato transaminasa, alanina transaminasa, lactato deshidrogenasa, creatinina quinasa y azúcares en sangre en ayunas [ 56 ].
Los resultados de los ensayos clínicos mostraron que la miel Life Mel (LMH) redujo la incidencia de anemia en el 64% de los pacientes al disminuir la trombocitopenia y la neutropenia [ 162 ]. Un estudio demostró que las bacterias probióticas en la miel tienen múltiples acciones en la inmunidad: (a) protegen el sistema inmunológico dañado; (b) mejoran los niveles de inmunoglobulinas circulantes, la frecuencia del interferón y la actividad inmunofagocítica; y (c) cambian los eventos de las reacciones inducidas químicamente [ 163 ]. Se supone que los medicamentos sintéticos y los productos naturales como la miel inhiben la producción de PG [ 164 ]. La función inmunológica se puede restaurar mediante el tratamiento con inhibidores de prostaglandinas o reduciendo los niveles sistémicos de PGE2. El uso de la miel como inhibidor de PG para prevenir una enfermedad está surgiendo. La miel ha mostrado efectos inhibidores sobre la PGE2 en el edema agudo de la pata inducido por carragenina en ratas [ 107 ]. La Figura 14 muestra los posibles mecanismos de acción de la miel para sus efectos reguladores inmunológicos. Se recomiendan más investigaciones para dilucidar los efectos y mecanismos de los efectos inmunomoduladores, quizás utilizando desafíos inmunes artificiales.
Figura 14.
Mecanismos de los efectos inmunomoduladores de la miel. IFN- γ = interferón gamma; IFNGR1 = receptor 1 del interferón gamma; IL = interleucina; TNF- α = factor de necrosis tumoral alfa; PGE2 = prostaglandina E2; SCFA = ácido graso de cadena corta.
2.11. Efectos cardiovasculares de la miel
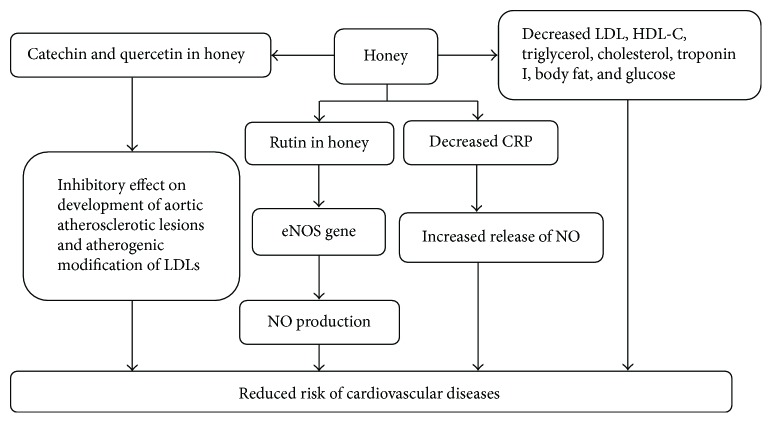
La miel tiene la capacidad de regular algunos factores de riesgo cardiovascular que incluyen la glucosa en sangre, el colesterol, la PCR (proteína C reactiva) y el peso corporal [ 43 ]. La miel contiene glucosa, fructosa y algunos oligoelementos como el cobre y el zinc, que pueden desempeñar un papel vital para mejorar los riesgos cardíacos. Hace que disminuyan los niveles de LDL (lipoproteína de baja densidad), colesterol de lipoproteína de alta densidad (HDL-C), triacilglicéridos, grasa corporal, glucosa y colesterol en pacientes cardíacos y sujetos humanos sanos que tomaron miel 70 g durante 30 días. Retarda el nivel de PCR, que estimula la producción de óxido nítrico [ 43 ]. El óxido nítrico tiene muchos efectos cardioprotectores que incluyen la regulación de la presión arterial, el tono vascular, la inhibición de la agregación plaquetaria, la adhesión de leucocitos y la prevención de la proliferación de células musculares lisas [ 165 ]. El NO actúa como un mediador crítico para la vasodilatación en los vasos sanguíneos. Es inducida por muchos factores como la acetilcolina, el estrés de corte y las citocinas a través de la síntesis de eNOS. El NO causa la fosforilación de varias proteínas que causa la relajación del músculo liso. El efecto vasodilatador del NO juega un papel importante en la regulación renal de la homeostasis del fluido extracelular y también es crítico para la regulación de la presión arterial y el flujo sanguíneo [ 165 , 166 ]. Se ha informado que algunos flavonoides en la miel modulan los riesgos cardiovasculares al disminuir el estrés oxidativo y aumentar la biodisponibilidad del óxido nítrico (NO). De manera similar, la rutina promueve la producción de NO al mejorar la expresión del gen eNOS y su actividad. La naringina inhibe la expresión de la molécula de adhesión intercelular inducida por hipercolesterolemia-1 (ICAM-1) en las células endoteliales. Estudios recientes han demostrado que la catequina y la quercetina como principales flavonoides de la miel tienen efectos inhibidores sobre el desarrollo de lesiones ateroscleróticas aórticas y la modificación aterogénica de LDL [ 167 ].
Se encontró que el pretratamiento con miel restablecía los niveles disminuidos de enzimas como la superóxido dismutasa, la glutatión peroxidasa y la glutatión reductasa, incluyendo la creatina quinasa-MB, la lactato deshidrogenasa, la aspartato transaminasa y la alanina transaminasa contra el infarto de miocardio inducido por isoproterenol en ratas Wistar [ 168 ]. Esto demuestra que la miel proporciona defensa contra los efectos nocivos provocados por los radicales libres letales [ 169 ]. Otro estudio ha demostrado que la miel provoca un aumento de los marcadores antioxidantes en el modelo de infarto de miocardio de rata, mejorando la troponina I cardíaca (cTnI), los triglicéridos (TG), el colesterol total (TC) y los productos de peroxidación lipídica (LPO) [ 169 ]. Todos los posibles mecanismos de los efectos cardiovasculares de la miel se han demostrado en la Figura 15. Sin embargo, los mecanismos de acción exactos de la miel siguen siendo oscuros para sus efectos cardiovasculares. Esto insta a una mayor investigación.
Figura 15.
Mecanismos de los efectos protectores cardiovasculares de la miel. eNOS = óxido nítrico sintasa endotelial; NO = óxido nítrico; LDL = lipoproteína de baja densidad; HDL-C = colesterol de lipoproteína de alta densidad; PCR = proteínas C reactivas.
3. Farmacocinética de la miel
La literatura carece de informes sobre la farmacocinética de la miel. Sin embargo, la investigación ha demostrado que la miel puede afectar la farmacocinética de algunos fármacos [ 170 ]. Estudios in vivo en humanos informaron que la miel interfiere con la actividad de las isoenzimas del citocromo p450 (CYP450) [ 170 ]. Las investigaciones clínicas preliminares sobre el efecto de la miel en la actividad de CYP450 sugieren que la miel podría aumentar la actividad de CYP3A4; sin embargo, no afecta la actividad de CYP2D6 y/o CYP2C19. También se observó que el aumento de la actividad de CYP3A4 requiere la ingestión regular de miel, mientras que es poco probable que la ingestión ocasional afecte significativamente las concentraciones plasmáticas del fármaco. Por lo tanto, la miel puede causar una respuesta alterada a los fármacos metabolizados por CYP3A4 [ 170 ]. CYP3A4 es la principal enzima metabolizadora de fármacos de fase I, y la P-glicoproteína es una bomba de eflujo de fármacos dependiente de ATP que regula la absorción intestinal de fármacos administrados por vía oral. Por el contrario, otro estudio en humanos informó que el consumo diario de miel no afecta las actividades hepáticas e intestinales del CYP3A y la glicoproteína P [ 171 , 172 ].
4. Limitaciones de la miel
La miel debe evaluarse por sus efectos toxicológicos en función de las plantas y/o la fuente de néctar. Aunque no todos, pero la intoxicación por miel puede esperarse, por ejemplo, la miel loca está contaminada con grayanotoxina. La grayanotoxina se encuentra en plantas de rododendro en países como China, Tíbet, Turquía, Nepal, Myanmar, Japón, Nueva Guinea, Filipinas, Indonesia y América del Norte. La miel loca recolectada en primavera es más tóxica y contiene más grayanotoxina [ 173 ]. La grayanotoxina causa intoxicación que puede incluir debilidad, mareos, transpiración excesiva, hipersalivación, náuseas, vómitos y parestesias. Incluso puede provocar complicaciones cardíacas potencialmente mortales, como bloqueo auriculoventricular completo [ 173 ]. La miel puede contaminarse con gérmenes de plantas, abejas y polvo durante la producción, recolección y/o procesamiento. Afortunadamente, la actividad antimicrobiana de la miel asegura que la mayoría de los gérmenes contaminantes no puedan sobrevivir o reproducirse. Sin embargo, las bacterias que pueden reproducirse usando esporas, incluidas las que causan botulismo, pueden sobrevivir. Esta es la razón por la que se ha informado de botulismo en bebés a los que se les ha administrado miel por vía oral. Para resolver este problema, la miel o la miel de grado médico debe irradiarse para inactivar las esporas bacterianas [ 174 ]. A veces, la alergia alimentaria debida a la miel suele acompañarse de una alergia al polen debido a la presencia de polen durante su recolección. Por lo tanto, la miel puede tener la posibilidad de sensibilidad en cualquier paciente con alergia alimentaria sospechada pero no resuelta [ 175 ]. Un consumo típico de azúcar y jarabe de maíz con alto contenido de fructosa (JMAF) totaliza casi ¾ de libra por día para cada individuo mayor de 2 años. Sin embargo, una cantidad, que simplemente abruma, da como resultado niveles elevados de azúcar en sangre, liberación excesiva de insulina y la consiguiente producción y almacenamiento de grasa en el hígado [ 176 ].
5. Conclusión
La miel puede considerarse un medicamento antioxidante natural con potencial serina. La investigación basada en evidencia muestra que la miel actúa a través de una vía moduladora de múltiples vías de señalización y objetivos moleculares. Puede interferir con múltiples objetivos en las vías de señalización celular, como la inducción de caspasas en la apoptosis, la estimulación de TNF- α , IL- 1β , IFN- γ , IFNGR1, p53 y células inmunes, la inhibición de la proliferación celular, la detención del ciclo celular, la inhibición de la oxidación de lipoproteínas, IL-1, IL-10, COX-2, LOX y PGE2, y la modulación de otros objetivos diversos. Esto da como resultado la activación de la mejora de las respuestas antioxidantes, antimutagénicas, antiinflamatorias, inmunorreguladoras y estrogénicas para reducir diferentes tipos de enfermedades. El efecto de la miel sobre la farmacocinética de los fármacos conduce a progresiones diferentes del cuerpo. Se necesitan más investigaciones para establecer los posibles mecanismos involucrados. También se pretenden realizar más ensayos clínicos y experimentales para validar la autenticidad de la miel, ya sea sola o como terapia coadyuvante.
Conflictos de intereses
Los autores declaran no tener ningún conflicto de intereses.
Referencias
- 1.Castro JA, deMecca MM, Bartel LC Efectos secundarios tóxicos de los fármacos utilizados para tratar la enfermedad de Chagas (tripanosomiasis americana) Human & Experimental Toxicology. 2006;25(8):471–479. doi: 10.1191/0960327106het653oa. [ DOI ] [ PubMed ] [ Google Scholar ]
- 2.Aggarwal BB, Shishodia S. Objetivos moleculares de los agentes dietéticos para la prevención y el tratamiento del cáncer. Farmacología bioquímica. 2006;71(10):1397–1421. doi: 10.1016/j.bcp.2006.02.009. [ DOI ] [ PubMed ] [ Google Scholar ]
- 3.Koehn FE, Carter GT El papel evolutivo de los productos naturales en el descubrimiento de fármacos. Nature Reviews Drug Discovery. 2005;4(3):206–220. doi: 10.1038/nrd1657. [ DOI ] [ PubMed ] [ Google Scholar ]
- 4.Othman NH ¿Tiene la miel las características de una vacuna natural contra el cáncer? Journal of Traditional and Complementary Medicine. 2012;2(4):276–283. doi: 10.1016/S2225-4110(16)30113-4. [ DOI ] [ PMC free article ] [ PubMed ] [ Google Scholar ]
- 5.Othman NH Miel y cáncer: relación inversa sostenible, en particular para los países en desarrollo: una revisión. Medicina complementaria y alternativa basada en evidencia. 2012;2012:10. doi: 10.1155/2012/410406.410406 [ DOI ] [ PMC free article ] [ PubMed ] [ Google Scholar ]
- 6.Ahmed S., Othman NH La miel como posible agente anticancerígeno natural: una revisión de sus mecanismos. Medicina complementaria y alternativa basada en evidencias. 2013;2013:7. doi: 10.1155/2013/829070.829070 [ DOI ] [ PMC free article ] [ PubMed ] [ Google Scholar ]
- 7.Molan P. La miel de manuka como medicina. Hamilton: Global Bioactives Summit; 2001. [ Google Scholar ]
- 8.Simon A., Traynor K., Santos K., Blaser G., Bode U., Molan P. Miel medicinal para el cuidado de heridas: ¿sigue siendo el «último recurso»? Medicina complementaria y alternativa basada en evidencia. 2009;6(2):165–173. doi: 10.1093/ecam/nem175. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 9.Editorial: Miel: ¿dulce y peligrosa o panacea? South African Medical Journal. 1974;48(56):p. 2300. [ PubMed ] [ Google Scholar ]
- 10.Condon RE Interacción curiosa entre insectos y abejas. Cirugía. 1993;113(2):234–235. [ PubMed ] [ Google Scholar ]
- 11.Rahman K. Análisis fitoquímico y composición química de diferentes muestras de miel de marca y sin marca. Revista internacional de investigación microbiológica. 2013;4(2):132–137. doi: 10.5829/idosi.ijmr.2013.4.2.1103. [ DOI ] [ Google Scholar ]
- 12.Hermosín I., Chicón RM, Cabezudo MD Composición de aminoácidos libres y origen botánico de la miel. Química de los alimentos. 2003;83(2):263–268. doi: 10.1016/S0308-8146(03)00089-X. [ DOI ] [ Google Scholar ]
- 13.Atrouse OM, Oran SA, Al-Abbadi SY Análisis químico e identificación de granos de polen de diferentes muestras de miel jordana. Revista internacional de ciencia y tecnología de los alimentos. 2004;39(4):413–417. doi: 10.1111/j.1365-2621.2004.00798.x. [ DOI ] [ Google Académico ]
- 14.Chen L., Mehta A., Berenbaum M., Zangerl AR, Engeseth NJ Mieles de diferentes fuentes florales como inhibidores del oscurecimiento enzimático en homogenizados de frutas y verduras. Journal of Agricultural and Food Chemistry. 2000;48(10):4997–5000. doi: 10.1021/jf000373j. [ DOI ] [ PubMed ] [ Google Scholar ]
- 15.Ball DW La composición química de la miel. Revista de Educación Química. 2007;84(10):p. 1643. doi: 10.1021/ed084p1643. [ DOI ] [ Google Académico ]
- 16.Miel de Miraglio AM: propiedades terapéuticas y beneficiosas para la salud. Longmont: The National Honey Board; 2008. [ Google Scholar ]
- 17.Erejuwa OO, Sulaiman SA, Wahab MSA Efectos de la miel y sus mecanismos de acción en el desarrollo y progresión del cáncer. Moléculas. 2014;19(2):2497–2522. doi: 10.3390/molecules19022497. [ DOI ] [ PMC free article ] [ PubMed ] [ Google Scholar ]
- 18.Ahmed S., Othman NH Revisión de los efectos medicinales de la miel de tualang y una comparación con la miel de manuka. Revista de Ciencias Médicas de Malasia. 2013;20(3):6–13. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 19.Cook NC, Samman S. Flavonoides: química, metabolismo, efectos cardioprotectores y fuentes dietéticas. The Journal of Nutritional Biochemistry. 1996;7(2):66–76. doi: 10.1016/0955-2863(95)00168-9. [ DOI ] [ Google Scholar ]
- 20.Catapano AL Efecto antioxidante de los flavonoides. Angiología. 1997;48(1):39–44. doi: 10.1177/000331979704800107. [ DOI ] [ PubMed ] [ Google Scholar ]
- 21.Ioku K., Tsushida T., Takei Y., Nakatani N., Terao J. Actividad antioxidante de la quercetina y los monoglucósidos de quercetina en solución y en bicapas de fosfolípidos. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1995;1234(1):99–104. doi: 10.1016/0005-2736(94)00262-N. [ DOI ] [ PubMed ] [ Google Scholar ]
- 22.Jaganathan SK, Mandal M. Participación de los tioles no proteicos, la disfunción mitocondrial, las especies reactivas de oxígeno y p53 en la apoptosis inducida por la miel. Investigational New Drugs. 2009;28(5):624–633. doi: 10.1007/s10637-009-9302-0. [ DOI ] [ PubMed ] [ Google Scholar ]
- 23.Abubakar MB, Abdullah WZ, Sulaiman SA, Suen AB Una revisión de los mecanismos moleculares de los efectos antileucémicos de los compuestos fenólicos en la miel. Revista Internacional de Ciencias Moleculares. 2012;13(12):15054–15073. doi: 10.3390/ijms131115054. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 24.Erejuwa OO, Sulaiman SA, Ab Wahab MS Miel: un nuevo antioxidante. Moléculas. 2012;17(12):4400–4423. doi: 10.3390/molecules17044400. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 25.Al-Mamary M., Al-Meeri A., Al-Habori M. Actividades antioxidantes y fenólicos totales de diferentes tipos de miel. Nutrition Research. 2002;22(9):1041–1047. doi: 10.1016/S0271-5317(02)00406-2. [ DOI ] [ Google Scholar ]
- 26.Molan PC Manuka Honey as a Medicine, en Global Bioactives Summit. Unidad de investigación sobre miel de Waikato: Universidad de Waikato; 2001. [ Google Scholar ]
- 27.Sherlock O., Dolan A., Athman R., et al. Comparación de la actividad antimicrobiana de la miel de Ulmo de Chile y la miel de Manuka contra Staphylococcus aureus, Escherichia coli y Pseudomonas aeruginosa resistentes a la meticilina. BMC Complementary and Alternative Medicine. 2010;10(1):p. 47. doi: 10.1186/1472-6882-10-47. [ DOI ] [ PMC free article ] [ PubMed ] [ Google Scholar ]
- 28.Wang X., Wang XH, Andrae L., Engeseth NJ Efecto antimutagénico de varias mieles y azúcares contra Trp-p-1. Journal of Agricultural and Food Chemistry. 2002;50(23):6923–6928. doi: 10.1021/jf025641n. [ DOI ] [ PubMed ] [ Google Scholar ]
- 29.Lusby PE, Coombes A., Wilkinson JM Miel: ¿un potente agente para la cicatrización de heridas? Journal of Wound Ostomy & Continence Nursing. 2002;29(6):295–300. doi: 10.1067/mjw.2002.129073. [ DOI ] [ PubMed ] [ Google Scholar ]
- 30.Erejuwa OO, Gurtu S., Sulaiman SA, Ab Wahab MS, Sirajudeen KN, Salleh MS Efectos hipoglucémicos y antioxidantes de la suplementación con miel en ratas con diabetes inducida por estreptozotocina. Revista internacional de investigación sobre vitaminas y nutrición. 2010;80(1):74–82. doi: 10.1024/0300-9831/a000008. [ DOI ] [ PubMed ] [ Google Scholar ]
- 31.Shahzad A., Cohrs RJ Actividad antiviral in vitro de la miel contra el virus varicela zóster (VZV): un estudio de medicina traslacional para un posible remedio para el herpes zóster. Translational Biomedicine. 2012;3(2):p. 2. doi: 10.3823/434. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 32.Irish J., Carter DA, Shokohi T., Blair SE La miel tiene un efecto antifúngico contra las especies de Candida. Medical Mycology. 2006;44(3):289–291. doi: 10.1080/13693780500417037. [ DOI ] [ PubMed ] [ Google Scholar ]
- 33.Swellam T., Miyanaga N., Onozawa M., et al. Actividad antineoplásica de la miel en un modelo experimental de implantación de cáncer de vejiga: estudios in vivo e in vitro. Revista Internacional de Urología. 2003;10(4):213–219. doi: 10.1046/j.0919-8172.2003.00602.x. [ DOI ] [ PubMed ] [ Google Scholar ]
- 34.Ghashm AA, Othman NH, Khattak MN, Ismail NM, Saini R. Efecto antiproliferativo de la miel de tualang en las líneas celulares de carcinoma de células escamosas y osteosarcoma oral. BMC Complementary and Alternative Medicine. 2010;10(1):p. 49. doi: 10.1186/1472-6882-10-49. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 35.Fukuda M., Kobayashi K., Hirono Y., et al. La miel de jungla mejora la función inmunitaria y la actividad antitumoral. Medicina complementaria y alternativa basada en evidencia. 2011;2011:8. doi: 10.1093/ecam/nen086.908743 [ DOI ] [ PMC free article ] [ PubMed ] [ Google Scholar ]
- 36.Tsiapara AV, Jaakkola M., Chinou I., et al. Bioactividad de extractos de miel griega en células de cáncer de mama (MCF-7), cáncer de próstata (PC-3) y cáncer de endometrio (Ishikawa): análisis del perfil de los extractos. Química alimentaria. 2009;116(3):702–708. doi: 10.1016/j.foodchem.2009.03.024. [ DOI ] [ Google Scholar ]
- 37.Gribel NV, Pashinskiĭ VG Las propiedades antitumorales de la miel. Voprosy Onkologii. 1990;36(6):704–709. [ PubMed ] [ Google Scholar ]
- 38.Tomasin R., Gomes-Marcondes MC La administración oral de aloe vera y miel reduce el crecimiento del tumor de Walker al disminuir la proliferación celular y aumentar la apoptosis en el tejido tumoral. Phytotherapy Research. 2011;25(4):619–623. doi: 10.1002/ptr.3293. [ DOI ] [ PubMed ] [ Google Scholar ]
- 39.Fauzi AN, Norazmi MN, Yaacob NS La miel de tualang induce la apoptosis y altera el potencial de la membrana mitocondrial de las líneas celulares de cáncer de mama y de cuello uterino en humanos. Food and Chemical Toxicology. 2011;49(4):871–878. doi: 10.1016/j.fct.2010.12.010. [ DOI ] [ PubMed ] [ Google Scholar ]
- 40.Jaganathan SK, Mandal M. Componentes de la miel y su efecto apoptótico en células de cáncer de colon. Journal of ApiProduct and ApiMedical Science. 2009;1(2):29–36. doi: 10.3896/ibra.4.01.2.02. [ DOI ] [ Google Scholar ]
- 41.Samarghandians S., Afshari JT, Davoodi S. La miel induce apoptosis en el carcinoma de células renales. Pharmacognosy Magazine. 2011;7(25):46–52. doi: 10.4103/0973-1296.75901. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 42.Ghashm AA, Othman NH, Khattak MN, Ismail NM, Saini R. Efecto antiproliferativo de la miel de tualang en las líneas celulares de carcinoma de células escamosas y osteosarcoma oral. BMC Complementary and Alternative Medicine. 2010;10(1):p. 49. doi: 10.1186/1472-6882-10-49. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 43.Yaghoobi N., Al-Waili N., Ghayour-Mobarhan M., et al. Miel natural y factores de riesgo cardiovascular; efectos sobre la glucosa en sangre, el colesterol, los triacilglicéridos, la proteína C reactiva y el peso corporal en comparación con la sacarosa. The Scientific World Journal. 2008;8:463–469. doi: 10.1100/tsw.2008.64. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 44.Erejuwa OO, Sulaiman SA, Wahab MSA, Sirajudeen KNS, Salleh MSM, Gurtu S. Respuestas diferenciales a la presión arterial y al estrés oxidativo en ratas Wistar-Kyoto diabéticas inducidas por estreptozotocina y ratas espontáneamente hipertensas: efectos del tratamiento antioxidante (miel). Revista Internacional de Ciencias Moleculares. 2011;12(12):1888–1907. doi: 10.3390/ijms12031888. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 45.Sulaiman SA, Hasan H., Deris ZZ, et al. El beneficio de la miel de tualang en la reducción de los síntomas respiratorios agudos entre los peregrinos del hajj de Malasia: un estudio preliminar. Journal of ApiProduct and ApiMedical Science. 2011;3(1):38–44. doi: 10.3896/IBRA.4.03.1.07. [ DOI ] [ Google Scholar ]
- 46.Zaid SS, Sulaiman SA, Sirajudeen KNM, Othman NH Los efectos de la miel de tualang en los órganos reproductores femeninos, el hueso tibial y el perfil hormonal en ratas ovariectomizadas: modelo animal para la menopausia. BMC Complementary and Alternative Medicine. 2010;10(1):p. 82. doi: 10.1186/1472-6882-10-82. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 47.Mohamed M., Sulaiman SA, Jaafar H., Sirajudeen KNS Efecto de diferentes dosis de miel de Malasia sobre los parámetros reproductivos en ratas macho adultas. Andrologia. 2012;44(Suplemento 1):182–186. doi: 10.1111/j.1439-0272.2010.01159.x. [ DOI ] [ PubMed ] [ Google Scholar ]
- 48.Mahaneem M., Sulaiman SA, Jaafar H., et al. Efecto de la miel en las funciones testiculares en ratas expuestas al humo del cigarrillo. Journal of ApiProduct and ApiMedical Science. 2011;3(1):12–17. doi: 10.3896/IBRA.4.03.1.03. [ DOI ] [ Google Scholar ]
- 49.Othman Z., Shafin N., Zakaria R., Hussain NHN, Mohammad WMZW Mejora de la memoria inmediata después de 16 semanas de suplementación con miel de tualang (agro mas) en mujeres posmenopáusicas sanas. Menopausia. 2011;18(11):1219–1224. doi: 10.1097/gme.0b013e31821e2044. [ DOI ] [ PubMed ] [ Google Scholar ]
- 50.Eteraf-Oskouei T., Najafi M. Usos tradicionales y modernos de la miel natural en enfermedades humanas: una revisión. Revista Iraní de Ciencias Médicas Básicas. 2013;16(6):731–742. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 51.Bogdanov S., Jurendic T., Sieber R., Gallmann P. Miel para la nutrición y la salud: una revisión. Journal of the American College of Nutrition. 2008;27(6):677–689. doi: 10.1080/07315724.2008.10719745. [ DOI ] [ PubMed ] [ Google Scholar ]
- 52.Halliwell B., Gutteridge JM Peroxidación lipídica: una reacción en cadena de radicales. Free Radical Biology & Medicine. 1989;2:188–218. [ Google Académico ]
- 53.Nagai T., Sakai M., Inoue R., Inoue H., Suzuki N. Actividades antioxidantes de algunas mieles, jalea real y propóleos comercializados. Química alimentaria. 2001;75(2):237–240. doi: 10.1016/S0308-8146(01)00193-5. [ DOI ] [ Google Académico ]
- 54.Diplock AT, Rice-Evans CA, Burdon RH ¿Tiene la peroxidación lipídica un papel importante en la aparición de neoplasias malignas y los antioxidantes en la prevención del cáncer? Cancer Research. 1994;54(Suplemento 7):1952s–1956s. [ PubMed ] [ Google Scholar ]
- 55.Aljadi AM, Kamaruddin MY Evaluación de los contenidos fenólicos y las capacidades antioxidantes de dos mieles florales de Malasia. Química alimentaria. 2004;85(4):513–518. doi: 10.1016/S0308-8146(02)00596-4. [ DOI ] [ Google Scholar ]
- 56.Al-Waili NS Efectos del consumo diario de solución de miel sobre los índices hematológicos y los niveles sanguíneos de minerales y enzimas en individuos normales. Journal of Medicinal Food. 2003;6(2):135–140. doi: 10.1089/109662003322233549. [ DOI ] [ PubMed ] [ Google Scholar ]
- 57.Van Acker SABE, van Acker SA, van den Berg DJ, et al. Aspectos estructurales de la actividad antioxidante de los flavonoides. Free Radical Biology & Medicine. 1996;20(3):331–342. doi: 10.1016/0891-5849(95)02047-0. [ DOI ] [ PubMed ] [ Google Scholar ]
- 58.Israili ZH Propiedades antimicrobianas de la miel. American Journal of Therapeutics. 2014;21(4):304–323. doi: 10.1097/MJT.0b013e318293b09b. [ DOI ] [ PubMed ] [ Google Scholar ]
- 59.Nasir N.-AM, Halim AS, Singh KKB, Dorai AA, Haneef MNM Propiedades antibacterianas de la miel de tualang y su efecto en el tratamiento de heridas por quemaduras: un estudio comparativo. BMC Complementary and Alternative Medicine. 2010;10(1):p. 31. doi: 10.1186/1472-6882-10-31. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 60.Halim A., Kaur BK, Doraia A. Contracción de la herida y propiedades antimicrobianas de la miel de tualang en heridas por quemaduras de espesor total en ratas. Journal of ApiProduct and ApiMedical Science. 2010;2(1):31–60. [ Google Scholar ]
- 61.Bogdanov S. La miel como nutriente y alimento funcional: una revisión. Bee Product Science. 2011 [ Google Scholar ]
- 62.Mandal MD, Mandal S. Miel: sus propiedades medicinales y actividad antibacteriana. Revista de Biomedicina Tropical del Pacífico Asiático. 2011;1(2):154–160. doi: 10.1016/S2221-1691(11)60016-6. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 63.Koenig T., Roh JLC Curar heridas con miel. Revista de investigación de pregrado para las ciencias humanas. 2016;15(1) [ Google Scholar ]
- 64.Rückriemen J., Klemm O., Henle T. La miel de manuka (Leptospermum Scoparium) inhibe la actividad de la ureasa de la haba de canavalia debido al metilglioxal y la dihidroxiacetona. Química alimentaria. 2017;230:540–546. doi: 10.1016/j.foodchem.2017.03.075. [ DOI ] [ PubMed ] [ Google Scholar ]
- 65.Wang R., Starkey M., Hazan R., Rahme LG La capacidad de la miel para contrarrestar las infecciones bacterianas surge tanto de los compuestos bactericidas como de la inhibición de QS. Frontiers in Microbiology. 2012;3 doi: 10.3389/fmicb.2012.00144. [ DOI ] [ PMC free article ] [ PubMed ] [ Google Scholar ]
- 66.Merckoll P., Jonassen T. Ø., Vad ME, Jeansson SL, Melby KK Bacterias, biofilm y miel: un estudio de los efectos de la miel sobre las bacterias de heridas crónicas "planctónicas" e incrustadas en biofilm. Scandinavian Journal of Infectious Diseases. 2009;41(5):341–347. doi: 10.1080/00365540902849383. [ DOI ] [ PubMed ] [ Google Scholar ]
- 67.Halstead FD, Webber MA, Oppenheim BA Uso de una miel modificada genéticamente para erradicar biopelículas preformadas de patógenos importantes en heridas: un estudio in vitro. Journal of Wound Care. 2017;26(8):442–450. doi: 10.12968/jowc.2017.26.8.442. [ DOI ] [ PubMed ] [ Google Scholar ]
- 68.Alandejani T., Marsan J., Ferris W., Slinger R., Chan F. Eficacia de la miel en biopelículas de Staphylococcus aureus y Pseudomonas aeruginosa. Otorrinolaringología-Cirugía de Cabeza y Cuello. 2009;141(1):114–118. doi: 10.1016/j.otohns.2009.01.005. [ DOI ] [ PubMed ] [ Google Scholar ]
- 69.Emineke S., Cooper AJ, Fouch S., Birch BR, Lwaleed BA La miel diluida inhibe la formación de biopelículas: ¿aplicación potencial en el manejo del catéter urinario? Journal of Clinical Pathology. 2016;70(2):140–144. doi: 10.1136/jclinpath-2015-203546. [ DOI ] [ PubMed ] [ Google Scholar ]
- 70.Piotrowski M., Karpiński P., Pituch H., van Belkum A., Obuch-Woszczatyński P. Efectos antimicrobianos de la miel de Manuka en la formación de biopelículas in vitro por Clostridium difficile. Revista Europea de Microbiología Clínica y Enfermedades Infecciosas. 2017;36(9):1661–1664. doi: 10.1007/s10096-017-2980-1. [ DOI ] [ PubMed ] [ Google Scholar ]
- 71.Maddocks SE, Lopez MS, Rowlands RS, Cooper RA La miel de manuka inhibe el desarrollo de biopelículas de Streptococcus pyogenes y provoca una expresión reducida de dos proteínas de unión a la fibronectina. Microbiología. 2012;158(Parte 3):781–790. doi: 10.1099/mic.0.053959-0. [ DOI ] [ PubMed ] [ Google Scholar ]
- 72.Lee JH, Park JH, Kim JA, et al. Concentraciones bajas de miel reducen la formación de biopelículas, la detección de quórum y la virulencia en Escherichia coli O157:H7. Biofouling. 2011;27(10):1095–1104. doi: 10.1080/08927014.2011.633704. [ DOI ] [ PubMed ] [ Google Scholar ]
- 73.Falanga V. Cicatrización de heridas y su deterioro en el pie diabético. The Lancet. 2005;366(9498):1736–1743. doi: 10.1016/S0140-6736(05)67700-8. [ DOI ] [ PubMed ] [ Google Scholar ]
- 74.Visavadia BG, Honeysett J., Danford MH Apósito de miel de manuka: un tratamiento eficaz para las infecciones crónicas de las heridas. British Journal of Oral and Maxillofacial Surgery. 2008;46(1):55–56. doi: 10.1016/j.bjoms.2006.09.013. [ DOI ] [ PubMed ] [ Google Scholar ]
- 75.Imran F.-H., Dorai AA, Halim AS, Sulaiman WAW Hidrogel de miel de tualang en el tratamiento de zonas donantes de injertos de piel dividida. Journal of ApiProduct and ApiMedical Science. 2011;3(1):33–37. doi: 10.3896/IBRA.4.03.1.06. [ DOI ] [ Google Scholar ]
- 76.Bang LM, Buntting C., Molan P. El efecto de la dilución en la tasa de producción de peróxido de hidrógeno en la miel y sus implicaciones para la cicatrización de heridas. The Journal of Alternative & Complementary Medicine. 2003;9(2):267–273. doi: 10.1089/10755530360623383. [ DOI ] [ PubMed ] [ Google Scholar ]
- 77.Lin Z.-Q., Kondo T., Ishida Y., Takayasu T., Mukaida N. Participación esencial de IL-6 en el proceso de cicatrización de heridas de la piel, como se evidencia por la cicatrización tardía de heridas en ratones deficientes en IL-6. Journal of Leukocyte Biology. 2003;73(6):713–721. doi: 10.1189/jlb.0802397. [ DOI ] [ PubMed ] [ Google Scholar ]
- 78.Tonks AJ, Dudley E., Porter NG, et al. Un componente de 5,8 kDa de la miel de manuka estimula las células inmunitarias a través de TLR4. Journal of Leukocyte Biology. 2007;82(5):1147–1155. doi: 10.1189/jlb.1106683. [ DOI ] [ PubMed ] [ Google Scholar ]
- 79.Molan PC, Rhodes T. Honey: un apósito biológico para heridas. Heridas. 2015;27(6):141–151. [ PubMed ] [ Google Scholar ]
- 80.Halliwell B., Gutteridge JMC Radicales libres en biología y medicina. Oxford, Reino Unido: Clarendon Press; 2007. [ Google Académico ]
- 81.Alvarez-Suarez JM, Giampieri F., Cordero M., et al. La activación de la señalización AMPK/Nrf2 por la miel de Manuka protege a los fibroblastos dérmicos humanos contra el daño oxidativo al mejorar la respuesta antioxidante y la función mitocondrial, promoviendo la cicatrización de heridas. Journal of Functional Foods. 2016;25:38–49. doi: 10.1016/j.jff.2016.05.008. [ DOI ] [ Google Scholar ]
- 82.PC M. La actividad antibacteriana de la miel. 1. La naturaleza de la actividad antibacteriana. Bee World. 1992;73(1):5–28. [ Google Scholar ]
- 83.Abuharfeil N., Al-Oran R., Abo-Shehada M. El efecto de la miel de abeja en la actividad proliferativa de los linfocitos B y T humanos y la actividad de los fagocitos. Inmunología alimentaria y agrícola. 1999;11(2):169–177. doi: 10.1080/09540109999843. [ DOI ] [ Google Scholar ]
- 84.Anyanwu C. Investigación de la actividad antifúngica in vitro de la miel. Journal of Medicinal Plants Research. 2012;6(18):3512–3516. doi: 10.5897/jmpr12.577. [ DOI ] [ Google Scholar ]
- 85.Cushnie TT, Lamb AJ Actividad antimicrobiana de los flavonoides. Revista internacional de agentes antimicrobianos. 2005;26(5):343–356. doi: 10.1016/j.ijantimicag.2005.09.002. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 86.Kwakman PH, te Velde AA, de Boer L., Speijer D., Vandenbroucke-Grauls CM, Zaat SA Cómo la miel mata las bacterias. La Revista FASEB. 2010;24(7):2576–2582. doi: 10.1096/fj.09-150789. [ DOI ] [ PubMed ] [ Google Scholar ]
- 87.Nassar HM, Li M., Gregory RL Efecto de la miel en el crecimiento de Streptococcus mutans y la formación de biopelículas. Applied and Environmental Microbiology. 2012;78(2):536–540. doi: 10.1128/AEM.05538-11. [ DOI ] [ PMC free article ] [ PubMed ] [ Google Scholar ]
- 88.Al-Waili NS, Salom K., Butler G., al Ghamdi AA Miel e infecciones microbianas: una revisión que apoya el uso de la miel para el control microbiano. Journal of Medicinal Food. 2011;14(10):1079–1096. doi: 10.1089/jmf.2010.0161. [ DOI ] [ PubMed ] [ Google Scholar ]
- 89.Arnold J., Bailey G. Los acabados superficiales del acero inoxidable reducen la adhesión bacteriana y la formación temprana de biopelículas: estudio mediante microscopía electrónica de barrido y de fuerza atómica. Poultry Science. 2000;79(12):1839–1845. doi: 10.1093/ps/79.12.1839. [ DOI ] [ PubMed ] [ Google Scholar ]
- 90.Ansari MJ, al-Ghamdi A., Usmani S., et al. Efecto de la miel de azufaifo en el crecimiento y la formación de biopelículas de Candida albicans. Archivos de investigación médica. 2013;44(5):352–360. doi: 10.1016/j.arcmed.2013.06.003. [ DOI ] [ PubMed ] [ Google Scholar ]
- 91.Canonico B., Candiracci M., Citterio B., et al. Los flavonoides de la miel inhiben la morfogénesis de Candida albicans al afectar el comportamiento del ADN y la función mitocondrial. Future Microbiology. 2014;9(4):445–456. doi: 10.2217/fmb.14.17. [ DOI ] [ PubMed ] [ Google Scholar ]
- 92.Whitley RJ, Kimberlin DW, Roizman B. Virus del herpes simple. Enfermedades infecciosas clínicas. 1998;26(3):541–553. doi: 10.1086/514600. [ DOI ] [ PubMed ] [ Google Scholar ]
- 93.Kwakman PH, Te Velde AA, de Boer L., Vandenbroucke-Grauls CM, Zaat SA Dos mieles medicinales importantes tienen diferentes mecanismos de actividad bactericida. Más uno. 2011;6(3, artículo e17709) doi: 10.1371/journal.pone.0017709. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 94.Vynograd N., Vynograd I., Sosnowski Z. Un estudio multicéntrico comparativo de la eficacia del propóleo, el aciclovir y el placebo en el tratamiento del herpes genital (HSV) Phytomedicine. 2000;7(1):1–6. doi: 10.1016/S0944-7113(00)80014-8. [ DOI ] [ PubMed ] [ Google Scholar ]
- 95.Zeina B., Othman O., Al-Assad S. Efecto de la miel frente al tomillo en la supervivencia del virus de la rubéola in vitro. The Journal of Alternative and Complementary Medicine. 1996;2(3):345–348. doi: 10.1089/acm.1996.2.345. [ DOI ] [ PubMed ] [ Google Scholar ]
- 96.Al-Waili NS Aplicación tópica de miel frente a aciclovir para el tratamiento de lesiones recurrentes de herpes simple. Medical Science Monitor. 2004;10(8):MT94–MT98. [ PubMed ] [ Google Scholar ]
- 97.Al-Waili N., Boni N. Efectos de la ingestión de miel sobre el óxido nítrico en la saliva. FASEB Journal. 2003;17(5):p. 9650. [ Google Scholar ]
- 98.Yao L., Jiang Y., D'Arcy B., et al. Análisis cuantitativos de flavonoides en mieles de eucalipto australiano mediante cromatografía líquida de alto rendimiento. Journal of Agricultural and Food Chemistry. 2004;52(2):210–214. doi: 10.1021/jf034990u. [ DOI ] [ PubMed ] [ Google Scholar ]
- 99.Oršolić N., Bašić I. El derivado soluble en agua del propóleo y sus compuestos polifenólicos mejoran la actividad tumoricida de los macrófagos. Journal of Ethnopharmacology. 2005;102(1):37–45. doi: 10.1016/j.jep.2005.05.036. [ DOI ] [ PubMed ] [ Google Scholar ]
- 100.Vandamme L., Heyneman A., Hoeksema H., Verbelen J., Monstrey S. La miel en el cuidado moderno de heridas: una revisión sistemática. Burns. 2013;39(8):1514–1525. doi: 10.1016/j.burns.2013.06.014. [ DOI ] [ PubMed ] [ Google Scholar ]
- 101.Lee WM Acetaminophen and the US acute liver failure study group: reduction the risk of hepatic failure [Paracetamol y el grupo de estudio de insuficiencia hepática aguda de EE. UU.: reducción de los riesgos de insuficiencia hepática]. Hepatology [Hepatología]. 2004;40(1):6–9. doi: 10.1002/hep.20293. [ DOI ] [ PubMed ] [ Google Scholar ]
- 102.Abdel-Moneim WM, Ghafeer HH El potencial efecto protector de la miel natural contra la hepatotoxicidad y nefrotoxicidad inducidas por cadmio. Mansoura Journal of Forensic Medicine Clinical Toxicology. 2007;15:75–92. [ Google Scholar ]
- 103.Chant A. Biomecánica de la ulceración de la pierna. Anales del Real Colegio de Cirujanos de Inglaterra. 1999;81(2):80–85. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 104.Subrahmanyam M. Un estudio clínico e histológico aleatorizado prospectivo de la cicatrización de heridas por quemaduras superficiales con miel y sulfadiazina de plata. Burns. 1998;24(2):157–161. doi: 10.1016/S0305-4179(97)00113-7. [ DOI ] [ PubMed ] [ Google Scholar ]
- 105.Al-Waili NS, Boni NS La miel natural reduce las concentraciones plasmáticas de prostaglandinas en individuos normales. Journal of Medicinal Food. 2003;6(2):129–133. doi: 10.1089/109662003322233530. [ DOI ] [ PubMed ] [ Google Scholar ]
- 106.Hussein SZ, Mohd Yusoff K., Makpol S., Mohd Yusof YA La miel de gelam atenúa la inflamación de las patas de rata inducida por carragenina a través de la vía NF-κB. PLoS One. 2013;8(8, artículo e72365) doi: 10.1371/journal.pone.0072365. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 107.Hussein SZ, Mohd Yusoff K., Makpol S., Mohd Yusof YA La miel de gelam inhibe la producción de mediadores proinflamatorios, NO, PGE(2), TNF-α e IL-6 en el edema agudo de la pata inducido por carragenina en ratas. Medicina complementaria y alternativa basada en evidencia. 2012;2012:13. doi: 10.1155/2012/109636.109636 [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 108.Murtaza G., Karim S., Akram MR, et al. Éster de ácido cafeico fenetílico y potencial terapéutico. BioMed Research International. 2014;2014:9. doi: 10.1155/2014/145342.145342 [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 109.Candiracci M., Piatti E., Dominguez-Barragán M., et al. Actividad antiinflamatoria de un extracto de flavonoide de miel sobre células microgliales N13 activadas por lipopolisacáridos. Journal of Agricultural and Food Chemistry. 2012;60(50):12304–12311. doi: 10.1021/jf302468h. [ DOI ] [ PubMed ] [ Google Scholar ]
- 110.Tonks A., Cooper RA, Price AJ, Molan PC, Jones KP Estimulación de la liberación de TNF-α en monocitos por la miel. Cytokine. 2001;14(4):240–242. doi: 10.1006/cyto.2001.0868. [ DOI ] [ PubMed ] [ Google Scholar ]
- 111.Tomblin V., Ferguson LR, Han DY, Murray P., Schlothauer R. Posible vía de efecto antiinflamatorio de las mieles de Nueva Zelanda. Revista Internacional de Medicina General. 2014;7:149–158. doi: 10.2147/IJGM.S45839. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 112.Molan PC Potencial de la miel en el tratamiento de heridas y quemaduras. American Journal of Clinical Dermatology. 2001;2(1):13–19. doi: 10.2165/00128071-200102010-00003. [ DOI ] [ PubMed ] [ Google Scholar ]
- 113.Gupta SS, Singh O., Bhagel PS, Moses S., Shukla S., Mathur RK Apósito de miel versus apósito de sulfadiazeno de plata para la cicatrización de heridas en pacientes con quemaduras: un estudio retrospectivo. Journal of Cutaneous and Aesthetic Surgery. 2011;4(3):183–187. doi: 10.4103/0974-2077.91249. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 114.Hong J., Smith TJ, Ho CT, August DA, Yang CS Efectos de los polifenoles purificados del té verde y negro en el metabolismo dependiente de la ciclooxigenasa y la lipoxigenasa del ácido araquidónico en la mucosa del colon humano y en los tejidos tumorales del colon. Farmacología bioquímica. 2001;62(9):1175–1183. doi: 10.1016/S0006-2952(01)00767-5. [ DOI ] [ PubMed ] [ Google Scholar ]
- 115.Matteucci E., Giampietro O. Estrés oxidativo en familias de pacientes diabéticos tipo 1. Cuidado de la diabetes. 2000;23(8):1182–1186. doi: 10.2337/diacare.23.8.1182. [ DOI ] [ PubMed ] [ Google Scholar ]
- 116.Brownlee M. Glicosilación avanzada de proteínas en la diabetes y el envejecimiento. Revista Anual de Medicina. 1995;46(1):223–234. doi: 10.1146/annurev.med.46.1.223. [ DOI ] [ PubMed ] [ Google Académico ]
- 117.Elgawish A., Glomb M., Friedlander M., Monnier VM Participación del peróxido de hidrógeno en la reticulación del colágeno por niveles altos de glucosa in vitro e in vivo. Journal of Biological Chemistry. 1996;271(22):12964–12971. doi: 10.1074/jbc.271.22.12964. [ DOI ] [ PubMed ] [ Google Scholar ]
- 118.Kitabchi AE, Umpierrez GE, Miles JM, Fisher JN Crisis hiperglucémicas en pacientes adultos con diabetes. Diabetes Care. 2009;32(7):1335–1343. doi: 10.2337/dc09-9032. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 119.Al-Waili N. Administración intrapulmonar de solución de miel natural, dextrosa hiperosmolar o agua destilada hipoosmolar a individuos normales y a pacientes con diabetes mellitus tipo 2 o hipertensión: sus efectos sobre el nivel de glucosa en sangre, insulina plasmática y péptido C, presión arterial y flujo espiratorio máximo. Revista Europea de Investigación Médica. 2003;8(7):295–303. [ PubMed ] [ Google Académico ]
- 120.Erejuwa OO, Sulaiman SA, Ab Wahab MS La miel: un nuevo agente antidiabético. Revista internacional de ciencias biológicas. 2012;8(6):913–934. doi: 10.7150/ijbs.3697. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 121.Erejuwa OO, Gurtu S., Sulaiman SA, Ab Wahab MS, Sirajudeen KN, Salleh MS Efectos hipoglucémicos y antioxidantes de la suplementación con miel en ratas con diabetes inducida por estreptozotocina. Revista internacional de investigación sobre vitaminas y nutrición. 2010;80(1):74–82. doi: 10.1024/0300-9831/a000008. [ DOI ] [ PubMed ] [ Google Scholar ]
- 122.Erejuwa OO, Sulaiman SA, Wahab MSA La fructosa podría contribuir al efecto hipoglucémico de la miel. Molecules. 2012;17(12):1900–1915. doi: 10.3390/molecules17021900. [ DOI ] [ PMC free article ] [ PubMed ] [ Google Scholar ]
- 123.Kashimura J., Nagai Y. Efecto inhibidor de la palatinosa sobre la absorción de glucosa en el intestino evertido de ratas. Journal of Nutritional Science and Vitaminology. 2007;53(1):87–89. doi: 10.3177/jnsv.53.87. [ DOI ] [ PubMed ] [ Google Scholar ]
- 124.Jones HF, Butler RN, Brooks DA Transporte intestinal de fructosa y malabsorción en humanos. American Journal of Physiology-Gastrointestinal and Liver Physiology. 2011;300(2):G202–G206. doi: 10.1152/ajpgi.00457.2010. [ DOI ] [ PubMed ] [ Google Scholar ]
- 125.Thibault L. Carbohidratos dietarios: efectos sobre la autoselección, la glucosa plasmática y la insulina, y los sistemas indolaminérgicos cerebrales en ratas. Appetite. 1994;23(3):275–286. doi: 10.1006/appe.1994.1059. [ DOI ] [ PubMed ] [ Google Scholar ]
- 126.Wright EM, Martín MNG, Turk E. Absorción intestinal en la salud y la enfermedad: azúcares. Best Practice & Research Clinical Gastroenterology. 2003;17(6):943–956. doi: 10.1016/S1521-6918(03)00107-0. [ DOI ] [ PubMed ] [ Google Scholar ]
- 127.Schürmann A. Una mirada a los transportadores de hexosas “extraños” GLUT3, GLUT5 y GLUT7. American Journal of Physiology-Endocrinology and Metabolism. 2008;295(2):E225–E226. doi: 10.1152/ajpendo.90406.2008. [ DOI ] [ PubMed ] [ Google Scholar ]
- 128.Stelmańska E. El papel importante de GLUT2 en el transporte y absorción intestinal de azúcar. Postepy Biochemii. 2008;55(4):385–387. [ PubMed ] [ Google Scholar ]
- 129.Henry RR, Crapo PA, Thorburn AW Cuestiones actuales en el metabolismo de la fructosa. Revista anual de nutrición. 1991;11(1):21–39. doi: 10.1146/annurev.nu.11.070191.000321. [ DOI ] [ PubMed ] [ Google Scholar ]
- 130.Douard V., Ferraris RP Regulación del transportador de fructosa GLUT5 en la salud y la enfermedad. American Journal of Physiology-Endocrinology and Metabolism. 2008;295(2):E227–E237. doi: 10.1152/ajpendo.90245.2008. [ DOI ] [ PMC free article ] [ PubMed ] [ Google Scholar ]
- 131.Kwon S., Kim YJ, Kim MK Efecto de la alimentación con fructosa o sacarosa en diferentes niveles sobre la prueba de tolerancia oral a la glucosa en ratas normales y diabéticas tipo 2. Nutrition Research and Practice. 2008;2(4):252–258. doi: 10.4162/nrp.2008.2.4.252. [ DOI ] [ PMC free article ] [ PubMed ] [ Google Scholar ]
- 132.Van Schaftingen E., Davies DR La administración de fructosa estimula la fosforilación de la glucosa en el hígado de ratas anestesiadas. The FASEB Journal. 1991;5(3):326–330. doi: 10.1096/fasebj.5.3.2001793. [ DOI ] [ PubMed ] [ Google Scholar ]
- 133.Youn JH, Kaslow H., Bergman R. Efecto de la fructosa en la supresión de la degradación del glucógeno hepático. Journal of Biological Chemistry. 1987;262(24):11470–11477. [ PubMed ] [ Google Scholar ]
- 134.Regan JJ, Doorneweerd DD, Gilboe DP, Nuttall FQ Influencia de la fructosa en los sistemas de glucógeno sintasa y fosforilasa en el hígado de rata. Metabolism. 1980;29(10):965–969. doi: 10.1016/0026-0495(80)90040-2. [ DOI ] [ PubMed ] [ Google Scholar ]
- 135.Batumalaie K., Zaman Safi S., Mohd Yusof K., Shah Ismail I., Devi Sekaran S., Qvist R. Efecto de la miel de gelam en las vías de señalización inducidas por estrés oxidativo en células pancreáticas de hámster. Revista Internacional de Endocrinología. 2013;2013:10. doi: 10.1155/2013/367312.367312 [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 136.Carnero A., Blanco-Aparicio C., Renner O., Link W., Leal J. La vía de señalización PTEN/PI3K/AKT en el cáncer: implicaciones terapéuticas. Current Cancer Drug Targets. 2008;8(3):187–198. doi: 10.2174/156800908784293659. [ DOI ] [ PubMed ] [ Google Scholar ]
- 137.Vincent EE, Elder DJE, Curwen J., Kilgour E., Hers I., Tavaré JM. Inhibición dual del receptor de insulina y del receptor del factor de crecimiento similar a la insulina-1 dirigida a las células de cáncer de pulmón de células no pequeñas. PLoS One. 2013;8(6, artículo e66963) doi: 10.1371/journal.pone.0066963. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 138.Erejuwa OO Efecto de la miel en la diabetes mellitus: cuestiones que se plantean. Journal of Diabetes & Metabolic Disorders. 2014;13(1):p. 23. doi: 10.1186/2251-6581-13-23. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 139.Rao CV, Desai D., Kaul B., Amin S., Reddy BS Efecto de los ésteres de ácido cafeico sobre la mutagenicidad inducida por carcinógenos y el crecimiento de células de adenocarcinoma de colon humano. Interacciones químico-biológicas. 1992;84(3):277–290. doi: 10.1016/0009-2797(92)90129-9. [ DOI ] [ PubMed ] [ Google Scholar ]
- 140.Saxena S., Gautam S., Maru G., Kawle D., Sharma A. La supresión de la vía propensa a errores es responsable de la actividad antimutagénica de la miel. Food and Chemical Toxicology. 2012;50(3-4):625–633. doi: 10.1016/j.fct.2012.01.003. [ DOI ] [ PubMed ] [ Google Scholar ]
- 141.Shin HS, Ustunol Z. Influencia de los adobos que contienen miel en la formación de aminas aromáticas heterocíclicas y mutagenicidad general en filetes de res fritos y pechugas de pollo. Journal of Food Science. 2004;69(3):FCT147–FCT153. doi: 10.1111/j.1365-2621.2004.tb13350.x. [ DOI ] [ Google Scholar ]
- 142.Nicholson DW Del laboratorio a la clínica con agentes terapéuticos basados en la apoptosis. Nature. 2000;407(6805):810–816. doi: 10.1038/35037747. [ DOI ] [ PubMed ] [ Google Scholar ]
- 143.Earnshaw WC Cambios nucleares en la apoptosis. Current Opinion in Cell Biology. 1995;7(3):337–343. doi: 10.1016/0955-0674(95)80088-3. [ DOI ] [ PubMed ] [ Google Scholar ]
- 144.Susin SA, Zamzami N., Kroemer G. Mitocondrias como reguladores de la apoptosis: no hay más dudas. Biochimica et Biophysica Acta (BBA) - Bioenergética. 1998;1366(1-2):151–165. doi: 10.1016/S0005-2728(98)00110-8. [ DOI ] [ PubMed ] [ Google Scholar ]
- 145.Lee Y.-J., Kuo HC, Chu CY, Wang CJ, Lin WC, Tseng TH Participación de la proteína supresora tumoral p53 y p38 MAPK en la apoptosis inducida por éster de ácido cafeico fenetílico de células de glioma C6. Farmacología bioquímica. 2003;66(12):2281–2289. doi: 10.1016/j.bcp.2003.07.014. [ DOI ] [ PubMed ] [ Google Scholar ]
- 146.Pichichero E., Cicconi R., Mattei M., Muzi MG, Canini A. La miel de acacia y la crisina reducen la proliferación de células de melanoma a través de alteraciones en la progresión del ciclo celular. Revista Internacional de Oncología. 2010;37(4):973–981. doi: 10.3892/ijo_00000748. [ DOI ] [ PubMed ] [ Google Scholar ]
- 147.Tomasin R., Cintra Gomes-Marcondes MC La administración oral de aloe vera y miel reduce el crecimiento del tumor de Walker al disminuir la proliferación celular y aumentar la apoptosis en el tejido tumoral. Phytotherapy Research. 2010;25(4):619–623. doi: 10.1002/ptr.3293. [ DOI ] [ PubMed ] [ Google Scholar ]
- 148.Fernandez-Cabezudo MJ, el-Kharrag R., Torab F., et al. La administración intravenosa de miel de manuka inhibe el crecimiento tumoral y mejora la supervivencia del huésped cuando se utiliza en combinación con quimioterapia en un modelo murino de melanoma. PLoS One. 2013;8(2, artículo e55993) doi: 10.1371/journal.pone.0055993. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 149.Ahmed S., Sulaiman SA, Othman NH La administración oral de miel de tualang y de manuka modula la progresión del cáncer de mama en el modelo de ratas Sprague-Dawley. Medicina complementaria y alternativa basada en evidencia. 2017;2017:15. doi: 10.1155/2017/5904361.5904361 [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 150.Ahmed S., Othman NH Los efectos anticancerígenos de la miel de tualang en la modulación de la carcinogénesis mamaria: un estudio experimental en animales. BMC Complementary and Alternative Medicine. 2017;17(1):p. 208. doi: 10.1186/s12906-017-1721-4. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 151.Oršolić N., Benković V., Lisičić D., Đikić D., Erhardt J., Horvat Knežević A. Efectos protectores del propóleo y compuestos polifenólicos/flavonoides relacionados contra la toxicidad inducida por irinotecán. Oncología Médica. 2010;27(4):1346–1358. doi: 10.1007/s12032-009-9387-5. [ DOI ] [ PubMed ] [ Google Scholar ]
- 152.Diehl JA Ciclismo contra el cáncer con ciclina D1. Cancer Biology & Therapy. 2002;1(3):226–231. doi: 10.4161/cbt.72. [ DOI ] [ PubMed ] [ Google Scholar ]
- 153.Scholzen T., Gerdes J. La proteína Ki-67: de lo conocido y lo desconocido. Journal of Cellular Physiology. 2000;182(3):311–322. doi: 10.1002/(SICI)1097-4652(200003)182:3<311::AID-JCP1>3.0.CO;2-9. [ DOI ] [ PubMed ] [ Google Scholar ]
- 154.Orsolic N., Benković V., Horvat-Knežević A., Bašić I. Propóleo y flavonoides relacionados como agentes radioprotectores. En: Sharma RK, Rajesh A., editores. Radioinmunomoduladores a base de hierbas: aplicaciones en medicina, defensa nacional y espacio. Reino Unido: CABI Publishing; 2007. págs. 175–194. [ DOI ] [ Google Académico ]
- 155.Saroj P., Verma M., Jha K. Una visión general de la inmunomodulación. Revista de investigación científica avanzada. 2012;3(1):7–12. [ Google Académico ]
- 156.Syam Y., Natsir R., Rahardjo SP, Usman AN, Dwiyanti R., Hatta M. Efecto de la miel de trigona en la expresión de ARNm de interleucina-6 en ratones BALB/c inducidos por Salmonella Typhi. American Journal of Microbiological Research. 2016;4(3):77–80. doi: 10.12691/ajmr-4-3-2. [ DOI ] [ Google Scholar ]
- 157.Popa Morariu ID, Schiriac EC, Ungureanu D., Cuciureanu R. Respuesta inmune en ratas después de la administración de miel con residuos de sulfonamidas. Revista Român ă de Medicin ă de Laborator. 2012;20(1):63–72. [ Google Académico ]
- 158.Manyi-Loh CE, Clarke AM, Ndip N. Una descripción general de la miel: propiedades terapéuticas y contribución a la nutrición y la salud humana. Revista Africana de Investigación en Microbiología. 2011;5(8):844–852. [ Google Académico ]
- 159.Chepulis Lynne M. Los efectos de la miel en comparación con la sacarosa y una dieta sin azúcar sobre la fagocitosis de neutrófilos y el número de linfocitos después de una alimentación prolongada en ratas. Journal of Complementary and Integrative Medicine. 2007;4(1) doi: 10.2202/1553-3840.1098. [ DOI ] [ Google Scholar ]
- 160.Murosak S., Muroyama K., Yamamoto Y., Liu T., Yoshikai Y. Los nigerooligosacáridos aumentan la actividad de las células asesinas naturales de las células mononucleares hepáticas en ratones. Inmunofarmacología internacional. 2002;2(1):151–159. doi: 10.1016/s1567-5769(01)00152-7. [ DOI ] [ PubMed ] [ Google Scholar ]
- 161.Bíliková K., Simúth J. Nuevo criterio para la evaluación de la miel: cuantificación de la proteína de jalea real apalbúmina 1 en la miel mediante ELISA. Journal of Agricultural and Food Chemistry. 2010;58(15):8776–8781. doi: 10.1021/jf101583s. [ DOI ] [ PubMed ] [ Google Scholar ]
- 162.Zidan J., Shetver L., Gershuny A., et al. Prevención de la neutropenia inducida por quimioterapia mediante la ingesta especial de miel. Oncología médica. 2006;23(4):549–552. doi: 10.1385/MO:23:4:549. [ DOI ] [ PubMed ] [ Google Scholar ]
- 163.Jassawala MJ Probióticos y salud de la mujer. Revista de obstetricia y ginecología de la India. 2007;57(1):19–21. [ Google Scholar ]
- 164.Bincoletto C., Eberlin S., Figueiredo CAV, Luengo MB, Queiroz MLS Efectos producidos por la jalea real sobre la hematopoyesis: relación con la resistencia del huésped frente al desafío tumoral de ascitis de Ehrlich. Inmunofarmacología Internacional. 2005;5(4):679–688. doi: 10.1016/j.intimp.2004.11.015. [ DOI ] [ PubMed ] [ Google Scholar ]
- 165.Naseem KM El papel del óxido nítrico en las enfermedades cardiovasculares. Aspectos moleculares de la medicina. 2005;26(1-2):33–65. doi: 10.1016/j.mam.2004.09.003. [ DOI ] [ PubMed ] [ Google Scholar ]
- 166.Yoon Y., Song J., Hong SH, Kim JQ Concentraciones plasmáticas de óxido nítrico y polimorfismos del gen de la óxido nítrico sintasa en la enfermedad de la arteria coronaria. Química clínica. 2000;46(10):1626–1630. [ PubMed ] [ Google Scholar ]
- 167.Afroz R., Tanvir E., Little P. Flavonoides derivados de la miel: productos naturales para la prevención de la aterosclerosis y las enfermedades cardiovasculares. Farmacología clínica y experimental. 2016;06(03) doi: 10.4172/2161-1459.1000208. [ DOI ] [ Google Scholar ]
- 168.Afroz R., Tanvir EM, Karim N., et al. La miel de Sundarban confiere protección contra el infarto de miocardio inducido por isoproterenol en ratas Wistar. BioMed Research International. 2016;2016:10. doi: 10.1155/2016/6437641.6437641 [ DOI ] [ PMC free article ] [ PubMed ] [ Google Scholar ]
- 169.Khalil MI, Tanvir EM, Afroz R., Sulaiman SA, Gan SH Efectos cardioprotectores de la miel de tualang: mejora de los niveles de colesterol y enzimas cardíacas. BioMed Research International. 2015;2015:8. doi: 10.1155/2015/286051.286051 [ DOI ] [ PMC free article ] [ PubMed ] [ Google Scholar ]
- 170.Horn J., Hansten P. El efecto dulce de la miel en el metabolismo de los fármacos. Pharmacy Times. 2007;73(9):p. 48. [ Google Scholar ]
- 171.Fetzner L., Burhenne J., Weiss J., et al. El consumo diario de miel no modifica la actividad del CYP3A en humanos. The Journal of Clinical Pharmacology. 2011;51(8):1223–1232. doi: 10.1177/0091270010382022. [ DOI ] [ PubMed ] [ Google Scholar ]
- 172.Thomas V., Ramasamy K., Sundaram R., Chandrasekaran A. Efecto de la miel sobre la enzima CYP3A4 y la actividad de la glicoproteína P en voluntarios humanos sanos. Revista iraní de farmacología y terapéutica. 2008;6(2):p. 171. [ Google Académico ]
- 173.Gami R., Dhakal P. Envenenamiento por miel loca: una revisión. Journal of Clinical Toxicology. 2017;07(01):p. 5. doi: 10.4172/2161-0495.1000336. [ DOI ] [ Google Scholar ]
- 174.Versión NMCDC Honey Overview Information. Atlanta, GA, EE. UU.: WebMD; 2009. [ Google Scholar ]
- 175.Helbling A., Peter C., Berchtold E., Bogdanov S., Müller U. Alergia a la miel: relación con el polen y la alergia a las abejas. Allergy. 1992;47(1):41–49. doi: 10.1111/j.1398-9995.1992.tb02248.x. [ DOI ] [ PubMed ] [ Google Scholar ]
- 176.Miel SN Los efectos de la miel en el metabolismo humano. Miel Sweet Nechako; 2015. [ Google Scholar ]